Los enlaces covalentes son la fuerza que une a muchos de los compuestos que encontramos en nuestro entorno, desde el agua que bebemos hasta el aire que respiramos. Estos enlaces se forman cuando dos átomos comparten uno o más pares de electrones, dando lugar a moléculas estables. En esta clase exploraremos en detalle qué son los enlaces covalentes, sus diferentes tipos y cómo influye la polaridad en sus propiedades.
Objetivo de aprendizaje
- Comprender el concepto de enlace covalente y diferenciar entre sus distintos tipos, así como analizar la influencia de la polaridad en las propiedades de las moléculas.
1. Enlace covalente
Un enlace covalente se forma cuando dos átomos comparten uno o más pares de electrones. Esta compartición permite que ambos átomos alcancen una configuración electrónica más estable, similar a la de los gases nobles.
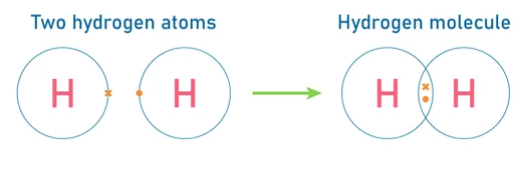
Enlace covalente simple
- Se forma cuando un par de electrones es compartido entre dos átomos.
- Ejemplo: La molécula de hidrógeno (H₂), donde cada átomo de hidrógeno comparte un electrón con el otro.
Enlace covalente doble
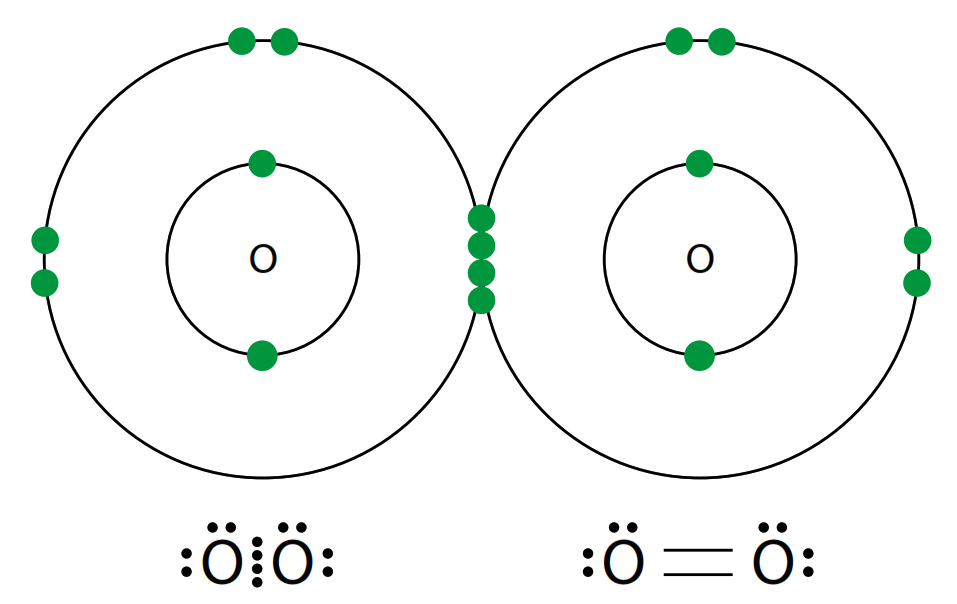
- Se forma cuando dos pares de electrones son compartidos entre dos átomos.
- Ejemplo: La molécula de oxígeno (O₂), donde cada átomo de oxígeno comparte dos electrones con el otro.
Enlace covalente triple
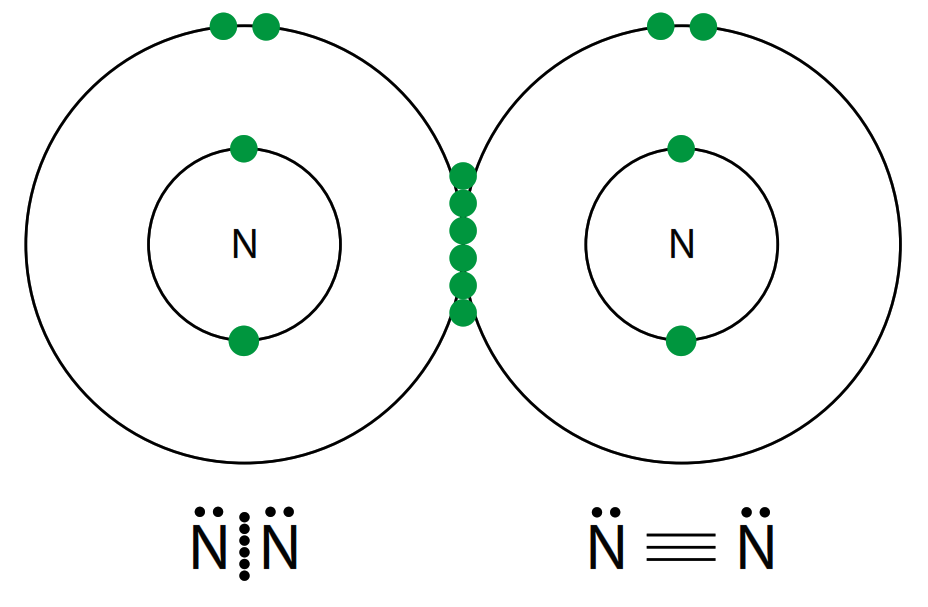
- Se forma cuando tres pares de electrones son compartidos entre dos átomos.
- Ejemplo: La molécula de nitrógeno (N₂), donde cada átomo de nitrógeno comparte tres electrones con el otro.
2. Polaridad
La polaridad de un enlace covalente depende de la diferencia de electronegatividad entre los átomos que lo forman. La electronegatividad es la capacidad de un átomo para atraer hacia sí los electrones de un enlace.
Enlace covalente polar:
Se forma entre átomos con diferente electronegatividad. El par de electrones compartido se encuentra más cerca del átomo más electronegativo, generando una distribución de carga asimétrica y formando un dipolo.
Ejemplo: La molécula de agua (H₂O), donde el oxígeno es más electronegativo que el hidrógeno.
Enlace covalente no polar:
Se forma entre átomos con igual o muy similar electronegatividad. El par de electrones compartido se encuentra en el punto medio entre los núcleos, generando una distribución de carga simétrica.
Ejemplo: La molécula de hidrógeno (H₂).
Influencia de la polaridad en las propiedades:
La polaridad de un enlace influye en las propiedades físicas y químicas de las sustancias, como:
- Punto de fusión y ebullición: Las moléculas polares tienen fuerzas intermoleculares más fuertes, lo que se traduce en puntos de fusión y ebullición más altos.
- Solubilidad: Las sustancias polares tienden a disolverse en solventes polares, mientras que las sustancias no polares se disuelven en solventes no polares.
- Conductividad eléctrica: Las sustancias con enlaces covalentes polares pueden ser conductoras de electricidad cuando se disuelven en agua, formando iones.
Laboratorio: Compuestos iónicos y covalentes
Los enlaces son uniones entre átomos. El enlace iónico se forma por la unión de cargas de signo contrario. Una sustancia conduce la corriente eléctrica en la medida que produce iones o posee electrones que se mueven a través del sólido. En esta práctica vas a identificar algunas sustancias iónicas y covalentes.
Reactivos:
- Sal común (NaCl)
- Azúcar en cubos (C₁₂H₂₂O₁₁)
- Glicerina (C₃H₅(OH)₃)
- Etanol al 98% (C₂H₅OH)
- Agua destilada
- Aceite de cocina
Materiales:
- 6 Vasos de precipitados de 250 mL
- 3 Probetas graduadas de 100 mL
- Balanza
- Mechero Bunsen
- Fósforos
- 3 Cables de cobre con pinzas caimán
- 1 Bombilla de linterna
- 1 Porta bombilla
- 2 Pilas
- Fuente de alimentación de corriente continua
- Láminas de cobre
- 2 Cucharas para combustión
- Reloj
Experimento 1: Descomposición y Fuerza de Enlace
Procedimiento:
- Azúcar:
- Coloca un cubo de azúcar en la cuchara de combustión.
- Introduce la cuchara en la zona azul de la llama del mechero Bunsen.
- Observa los cambios que ocurren cada 1, 5, 30 y 60 segundos.
- Sal común:
- Repite el paso 1 utilizando sal común.
Experimento 2: Conductividad eléctrica y tipo de enlace
Procedimiento:

- Montaje:
- Arma el circuito eléctrico según el diagrama proporcionado.
- Arma el circuito eléctrico según el diagrama proporcionado.
- Solución salina:
- Disuelve 5 g de sal común en 100 mL de agua destilada.
- Sumerge las láminas de cobre en la solución y observa si el bombillo se enciende.
- Disuelve 5 g de sal común en 100 mL de agua destilada.
- Solución azucarada:
- Repite el paso 2 utilizando azúcar en lugar de sal.
- Repite el paso 2 utilizando azúcar en lugar de sal.
- Líquidos puros:
- Llena tres vasos de precipitados con 100 mL de agua destilada, etanol al 98% y aceite de cocina, respectivamente.
- Sumerge las láminas de cobre en cada líquido y observa si el bombillo se enciende.
- Llena tres vasos de precipitados con 100 mL de agua destilada, etanol al 98% y aceite de cocina, respectivamente.
- Registro:
- Registra los resultados en una tabla.
Análisis de Resultados:
- ¿Qué relación existe entre el tipo de enlace y la conductividad eléctrica de las sustancias?
- ¿Por qué las sustancias con enlaces covalentes generalmente no conducen la electricidad?
- ¿Cuál es la razón por la que un ave posada en un cable de alta tensión no sufre una descarga eléctrica?
- ¿Por qué el agua de mar es conductora de la electricidad?
- ¿A qué se debe que el agua pura no conduzca la corriente eléctrica?
