La regla del octeto es uno de los principios fundamentales en la química que nos ayuda a comprender cómo se unen los átomos para formar moléculas y compuestos. Esta regla, propuesta por Gilbert N. Lewis, establece una tendencia general en la naturaleza de los átomos a alcanzar una configuración electrónica estable, similar a la de los gases nobles. En esta clase exploraremos en detalle qué es la regla del octeto, sus excepciones y su importancia en la formación de enlaces químicos.
Objetivo de aprendizaje
- Comprender la regla del octeto y aplicar este principio para predecir la formación de enlaces químicos y la estructura de moléculas.
- Comprender los principios básicos de la teoría RPECV.
- Predecir la geometría molecular de diferentes moléculas utilizando la teoría RPECV.
1. ¿Qué es la regla del octeto?
La regla del octeto establece que los átomos tienden a ganar, perder o compartir electrones para alcanzar una configuración electrónica de ocho electrones en su capa de valencia. Esta configuración es la misma que la de los gases nobles, que son extremadamente estables debido a su octeto completo de electrones.
¿Por qué es importante la regla del octeto?
La regla del octeto nos proporciona una herramienta útil para:
- Predecir la formación de enlaces químicos: Al conocer la configuración electrónica de los átomos, podemos predecir cuántos electrones necesita cada uno para completar su octeto y, por lo tanto, cuántos enlaces formará.
- Determinar la estructura de las moléculas: La regla del octeto nos ayuda a visualizar cómo se distribuyen los electrones en una molécula y a predecir su geometría.
2. Diagramas de Lewis: regla del octeto
Los diagramas de Lewis son una forma de representar la distribución de los electrones de valencia en un átomo o molécula. Estos diagramas nos ayudan a visualizar cómo se cumple la regla del octeto en la formación de enlaces.
Antes de empezar, debes saber que…
- Los elementos representativos adquieren la configuración de gas noble en casi todos sus compuestos (regla del octeto).
- La regla del octeto no nos lleva a escribir diagramas de Lewis.
- Hay que decidir dónde colocar electrones alrededor de los átomos enlazados; esto es, cuántos de los electrones de valencia disponibles están presentes como pares enlazantes (compartidos) y cuántos lo están como pares no compartidos (asociados a un solo átomo).

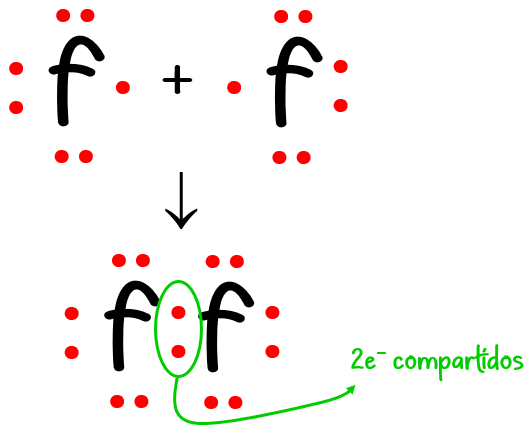
Ejemplo #1: Para el F2:
N = 2 · 8 (de 2 átomos de F) = 16 e– necesarios
D = 2 · 7 (de 2 átomos de F) = 14 e– disponibles
C = N – D = 16 – 14 = 2 e– compartidos.
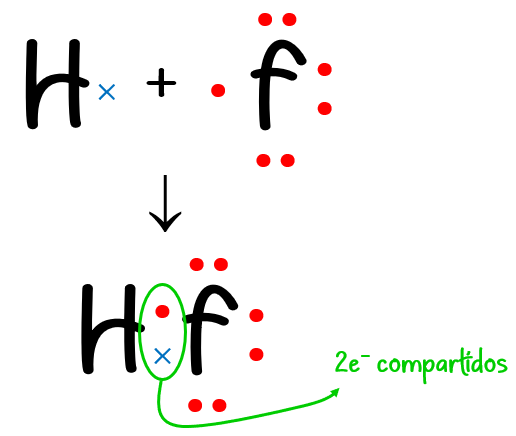
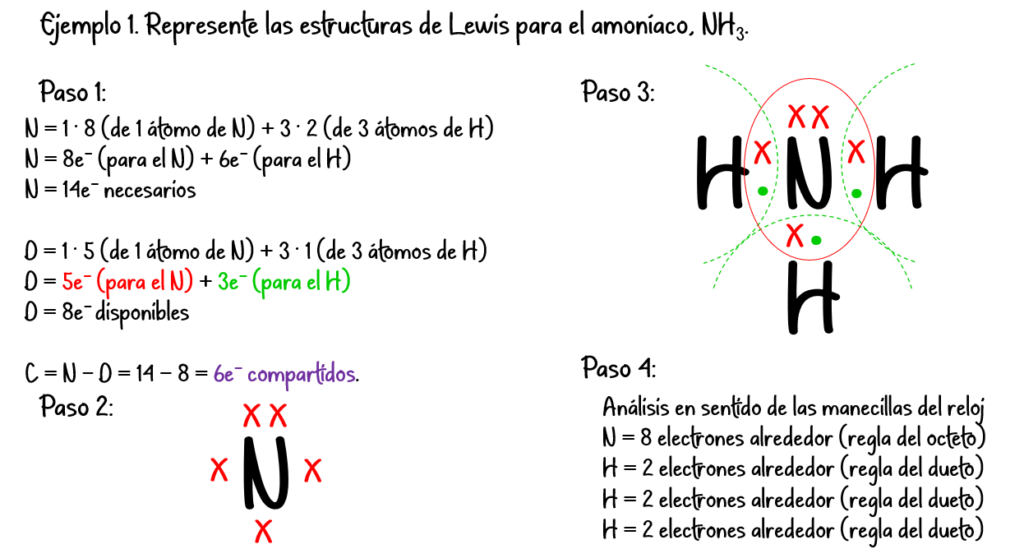
Ejemplo #2: Para el HF:
N = 1 · 2 (de 1 átomo de H) + 1 · 8 (de 1 átomo de F) = 10 e– necesarios
D = 1 · 1 (de 1 átomo de H) + 1 · 7 (de 1 átomo de F) = 8 e– disponibles
C = N – D = 10 – 8 = 2 e– compartidos.
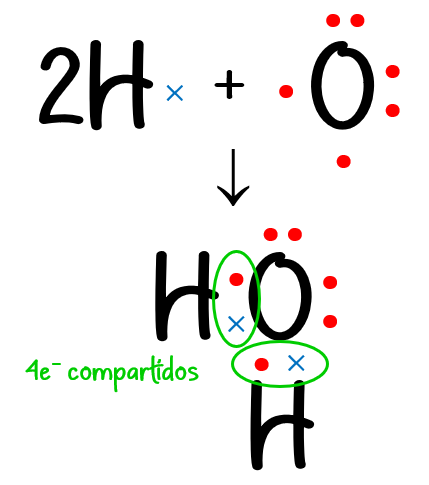
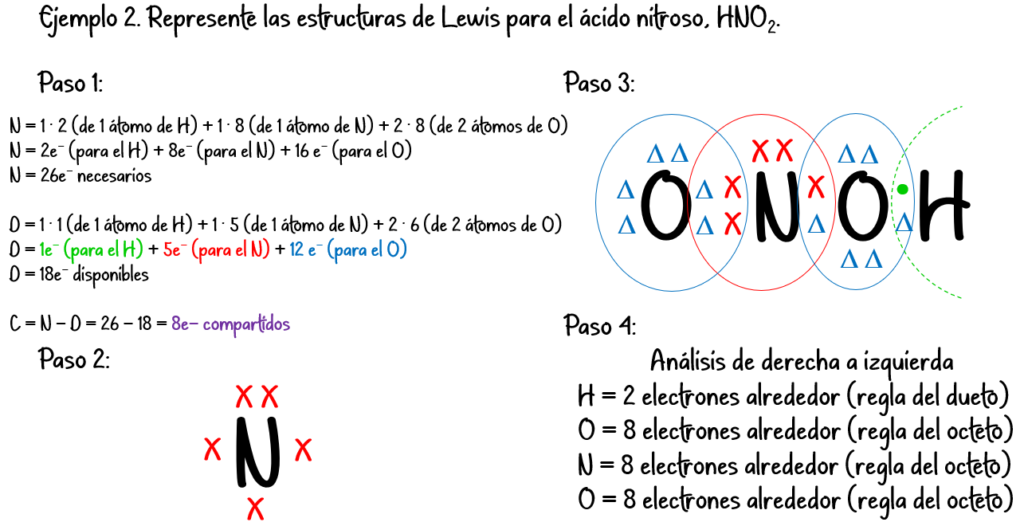
Ejemplo #3: Para el H2O:
N = 2 · 2 (de 2 átomos de H) + 1 · 8 (de 1 átomo de O) = 12 e– necesarios
D = 2 · 1 (de 2 átomos de H) + 1 · 6 (de 1 átomo de O) = 8 e– disponibles
C = N – D = 12 – 8 = 4 e– compartidos.
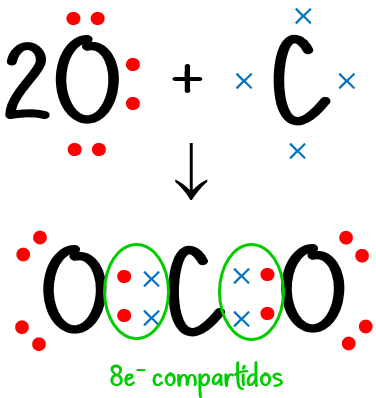
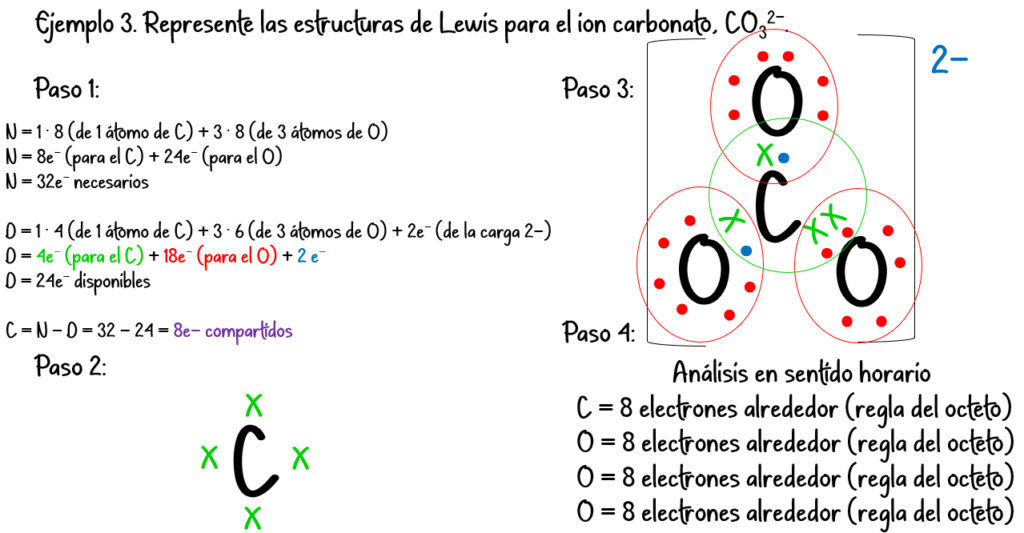
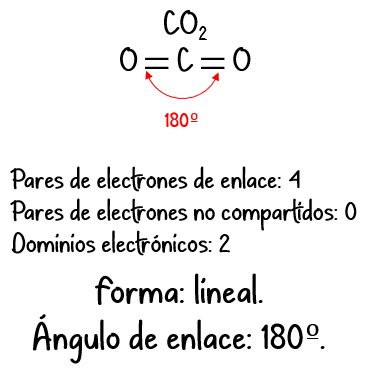
Ejemplo #4: Para el CO2:
N = 1 · 8 (de 1 átomo de C) + 2 · 8 (de 2 átomos de O) = 24 e– necesarios
D = 1 · 4 (de 1 átomo de C) + 2 · 6 (de 2 átomos de O) = 16 e– disponibles
C = N – D = 24 – 16 = 8 e– compartidos.
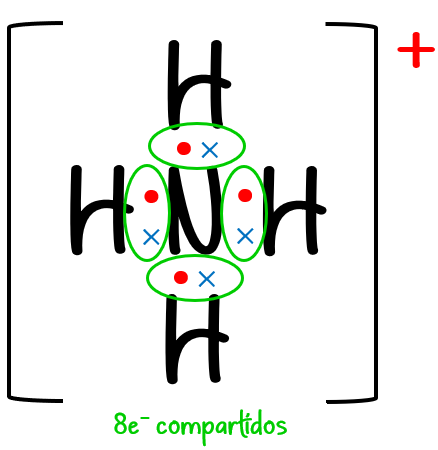
Ejemplo #5: Para el NH4+:
N = 1 · 8 (de 1 átomo de N) + 4 · 2 (de 4 átomos de H) = 16 e– necesarios
D = 1 · 5 (de 1 átomo de N) + 4 · 1 (de 4 átomos de H) – 1 (de la carga 1+) = 8 e– disponibles
C = N – D = 16 – 8 = 8 e– compartidos.
3. Guías para escribir fórmuals de Lewis
- Calcule C, el número total de electrones compartidos de la molécula o ion utilizando la relación C = N (electrones necesarios) – D (electrones disponibles).
- Dibujar el átomo central (o los átomos centrales) con sus electrones de valencia alrededor (representados por x o puntos).
- Dibujar el resto de los átomos alrededor del átomo central, haciendo coincidir un electrón de valencia de este último (del átomo central) con un electrón de valencia del átomo secundario.
- Contar el número de electrones alrededor de cada átomo. Los átomos H, Li y Be deben estar rodeados por dos electrones (correspondientes a los electrones del enlace) y los demás elementos deben estar rodeados por ocho electrones. Si se cumple el primer caso, entonces se dice que se cumple con la regla del dueto, y si se cumple el segundo caso, se dice que se cumple con la regla del octeto
4. Limitaciones a la regla del octeto
Existen varias moléculas que no obedecen a la regla del octeto. Hay tres tipos de excepciones:
- Moléculas en las que el átomo central tiene un octeto incompleto.
- Moléculas en las que el átomo central tiene un octeto ampliado.
- Moléculas con un número impar de electrones.
Octeto incompleto:
- Un átomo con menos de ocho electrones en su capa de valencia.
- El B en BH3 tiene un octeto incompleto.
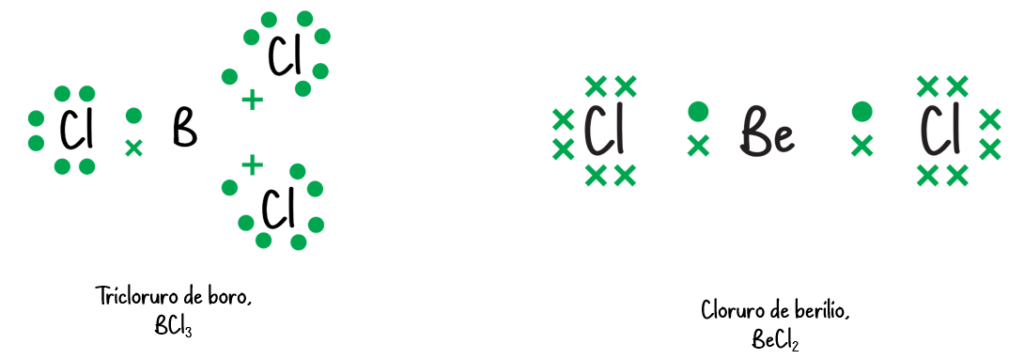
Octeto ampliado:
- Se puede producir en elementos del tercer período en adelante. Consiste en moléculas o iones en los que hay más de ocho electrones en la capa de valencia de un átomo.

Moléculas con un número impar de electrones:
- Las moléculas que tengan un número impar de electrones no podrán cumplir la regla del octeto ya que 8 es un número par. Ejemplo: •NO, •NO2, ClO2.
- Las moléculas y los iones con un electrón desapareado se denominan radicales libres.
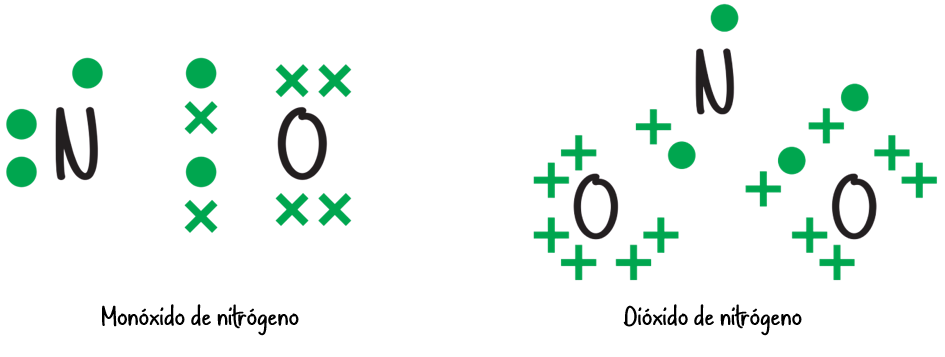
5. Teoría de repulsión de los pares de electrones de la capa de valencia (RPECV)
La Teoría de Repulsión de Pares de Electrones de la Capa de Valencia, o RPECV, permite a los científicos predecir la forma tridimensional de una molécula que está centrada alrededor de un átomo central. RPECV muestra la apariencia de una molécula en tres dimensiones. A los electrones no les gusta estar uno al lado del otro; se repelen, porque todos son negativos. Pero hay varios electrones, por lo que tienen que encontrar las posiciones con la menor repulsión.
La RPECV utiliza las siguientes reglas:
- Los pares de electrones en la capa de valencia de un átomo se repelerán o se alejarán unos de otros.
- Los pares de electrones no enlazados se encuentran más cerca del átomo y exhiben más repulsión que los pares enlazados.
La geometría molecular se determina por el número total de pares de electrones alrededor del átomo central y por la distribución de pares enlazantes y no enlazantes.
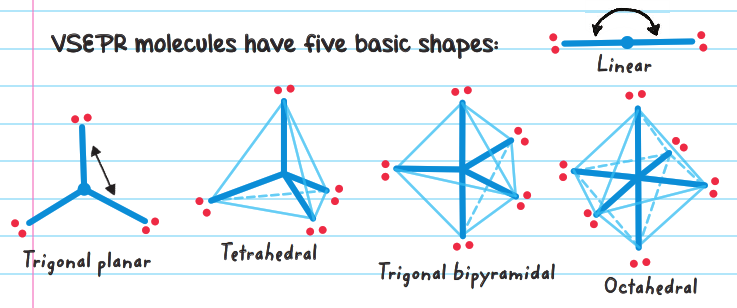
Pasos para aplicar la teoría RPECV:
- Dibujar la estructura de Lewis: Representar la distribución de los electrones de valencia en la molécula.
- Contar los pares de electrones alrededor del átomo central: Sumar los pares enlazantes y los pares no enlazantes.
- Determinar la geometría electrónica: La geometría electrónica se determina por el número total de pares de electrones y corresponde a una disposición geométrica específica (lineal, trigonal plana, tetraédrica, etc.).
- Determinar la geometría molecular: La geometría molecular se determina considerando solo los pares enlazantes y puede diferir de la geometría electrónica debido a la presencia de pares no enlazantes.
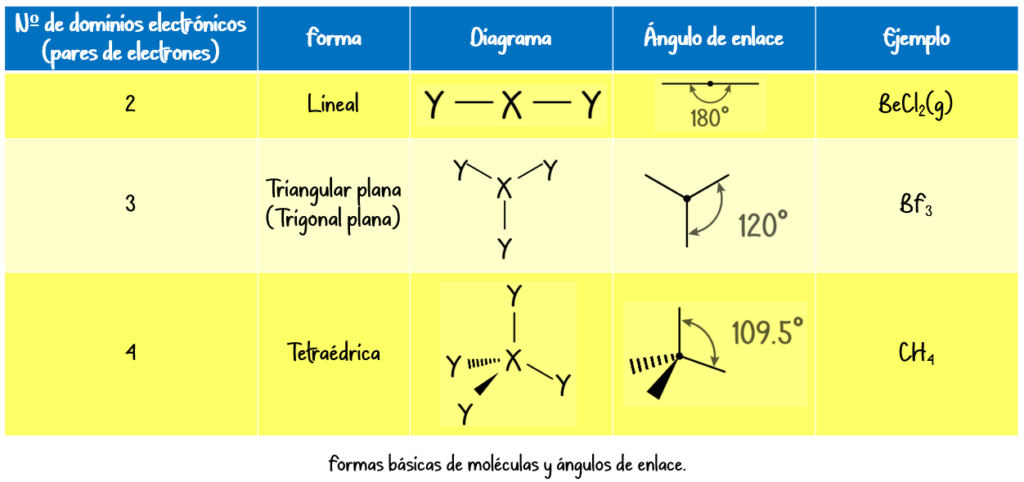
Geometrías moleculares comunes
| Número de pares de electrones | Geometría electrónica | Geometría molecular (sin pares no enlazantes) |
|---|---|---|
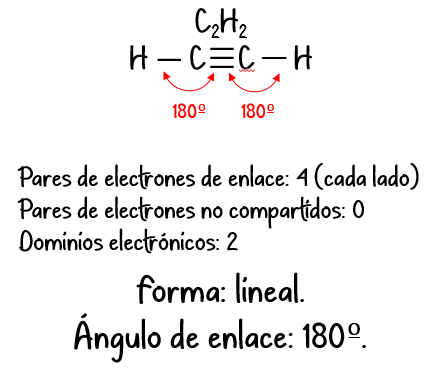
| 2 | Lineal | Lineal |
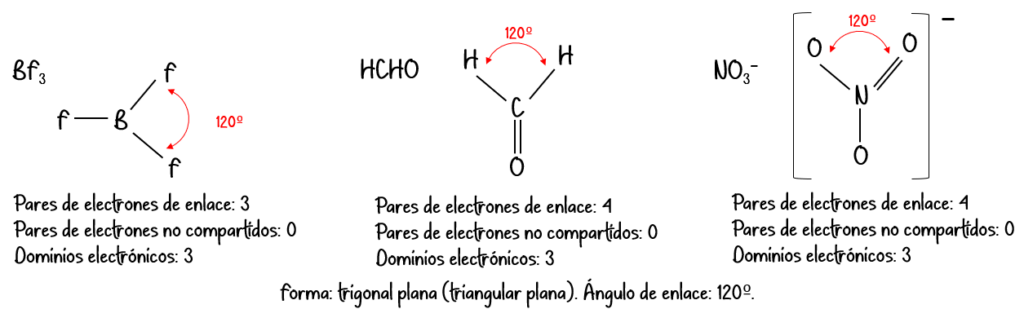
| 3 | Trigonal plana | Trigonal plana |
| 4 | Tetraédrica | Tetraédrica, piramidal trigonal, angular |
| 5 | Bipirámide trigonal | Bipirámide trigonal, bipirámide trigonal distorsionada, lineal |
| 6 | Octaédrica | Octaédrica, bipirámide cuadrada, cuadrada plana |


Influencia de la geometría molecular en las propiedades
La geometría molecular de una molécula influye en sus propiedades físicas y químicas, como:
- Polaridad: La distribución asimétrica de los electrones en una molécula polar puede generar un momento dipolar neto.
- Reactividad: La geometría molecular puede influir en la reactividad de una molécula al exponer o ocultar ciertos sitios reactivos.
- Propiedades físicas: La geometría molecular afecta a propiedades como el punto de fusión, el punto de ebullición y la solubilidad.
Actividad: Elaboración de estructuras de Lewis
Objetivo:
Familiarizar a los estudiantes con la creación de estructuras de Lewis, ayudándoles a entender visual y prácticamente cómo los electrones se distribuyen en los átomos y moléculas, y cómo los enlaces covalentes mantienen unidos a los átomos.
Materiales
- Botones de diferentes colores (representando diferentes átomos).
- Palillos de dientes (representando enlaces covalentes).
- Caramelos pequeños de colores (representando electrones).
- Cartulina o papel grande para montar estructuras.
- Marcadores para etiquetar.
- Asignación de Moléculas: Cada estudiante o grupo recibe una tarjeta con el nombre de una molécula común, como agua (H2O), dióxido de carbono (CO2), metano (CH4), amoníaco (NH3), etc.
- Construcción: Utilizando los materiales proporcionados, los estudiantes deben intentar construir la estructura de Lewis de su molécula asignada. Deben asegurarse de que el número de caramelos (electrones) alrededor de cada botón (átomo) refleje correctamente los electrones de valencia y que los palillos (enlaces) conecten los átomos adecuadamente.
- Una vez que los estudiantes hayan construido sus modelos, cada grupo presenta su molécula, explicando cómo distribuyeron los electrones y formaron los enlaces.
- Discutir cualquier error común o malentendidos que puedan surgir, enfocándose en cómo los electrones de valencia determinan la estructura de las moléculas.
