Las amidas son una clase de compuestos orgánicos derivados de los ácidos carboxílicos, en los cuales el grupo hidroxilo (-OH) es reemplazado por un grupo amina o un grupo amino (-NH₂, -NHR, -NR₂). Este tipo de compuestos tiene una estructura característica en la que el átomo de carbono del grupo carbonilo (C=O) está unido a un átomo de nitrógeno, el cual puede estar enlazado a un grupo alquilo o arilo. Las amidas son fundamentales en la química orgánica debido a su presencia en una gran cantidad de compuestos naturales y sintéticos, incluyendo proteínas, plásticos, productos farmacéuticos y agroquímicos.
Las amidas se encuentran ampliamente en la naturaleza, ya que son el componente estructural de las proteínas (en forma de enlaces peptídicos), y también son utilizadas en una gran variedad de aplicaciones industriales, como plásticos, fármacos y productos de limpieza. La química de las amidas involucra una serie de reacciones que permiten la formación de nuevos compuestos útiles en la síntesis orgánica y en el desarrollo de nuevas tecnologías.
Objetivo de aprendizaje
Comprender la estructura, propiedades y aplicaciones de las amidas, así como su importancia en la química orgánica y en diversos sectores industriales.
1. Propiedades de las amidas
- Estructura: La estructura general de una amida es R-CO-NH₂ (para una amida simple), donde R representa un grupo alquilo o arilo. En el caso de las amidas sustituidas, los grupos unidos al nitrógeno pueden ser R o R’ (grupos alquilo o arilo). La característica más importante de las amidas es el enlace C-N en el que el átomo de nitrógeno está enlazado a un átomo de carbono carbonilado (C=O). Este enlace es bastante estable debido a la resonancia que ocurre entre el grupo carbonilo y el átomo de nitrógeno, lo que da lugar a una estructura más estable y menos reactiva comparada con otros grupos funcionales como los ésteres.
- Solubilidad: Las amidas son solubles en agua (especialmente las amidas de bajo peso molecular) debido a su capacidad para formar enlaces de hidrógeno con las moléculas de agua. Sin embargo, su solubilidad disminuye a medida que aumentan el tamaño y la longitud de la cadena hidrocarbonada (R). Las amidas más grandes (como las que contienen grupos arilo) pueden ser menos solubles en agua, pero todavía pueden disolverse en solventes orgánicos polares.
- Punto de ebullición: Las amidas tienen puntos de ebullición relativamente altos en comparación con otros compuestos orgánicos, debido a la capacidad de formar enlaces de hidrógeno entre las moléculas. Este fenómeno incrementa las fuerzas intermoleculares y, por lo tanto, se requiere más energía para separarlas.
- Reactividad química:
- Hidrólisis: Las amidas son susceptibles a la hidrólisis tanto en condiciones ácidas como básicas. En un medio ácido, las amidas se convierten en un ácido carboxílico y una amina. En medio básico, se pueden formar sales de amonio. Este proceso es importante en la síntesis y descomposición de amidas.
- Reacción con ácidos y bases: Las amidas pueden reaccionar con ácidos y bases para formar productos como sales amónicas o amineas. También reaccionan con agentes deshidratantes para formar enlaces peptídicos en la biosíntesis de proteínas.
- Hidrólisis: Las amidas son susceptibles a la hidrólisis tanto en condiciones ácidas como básicas. En un medio ácido, las amidas se convierten en un ácido carboxílico y una amina. En medio básico, se pueden formar sales de amonio. Este proceso es importante en la síntesis y descomposición de amidas.
- Resonancia: El átomo de nitrógeno en las amidas está involucrado en una resonancia que estabiliza la estructura. El grupo carbonilo tiene un par de electrones que pueden ser parcialmente compartidos con el nitrógeno, formando una estructura intermedia entre una amina y un éster. Esto otorga a las amidas propiedades químicas que las hacen menos reactivas que otras especies orgánicas, pero también las hace útiles en diversas reacciones de síntesis.
2. Usos de las amidas
- Síntesis de proteínas: Las amidas están en el centro de la química biológica, específicamente en las proteínas. Las proteínas están formadas por cadenas de aminoácidos, que están unidas por enlaces peptídicos (un tipo de enlace amida). Estos enlaces amídicos permiten la formación de estructuras complejas y funcionales que desempeñan una variedad de funciones en los organismos vivos.
- Polímeros y plásticos: Las amidas se utilizan en la fabricación de varios plásticos y polímeros, especialmente en la producción de nylon, un polímero ampliamente utilizado en la fabricación de ropa, cuerdas, redes y otros productos textiles. El nylon 6,6, por ejemplo, es una amida sintética que se obtiene a partir de la reacción de un ácido dicarboxílico con una diamina. Además, las amidas también se encuentran en polímeros como las resinas epoxi.
- Fármacos y productos farmacéuticos: Muchas amidas tienen aplicaciones en la industria farmacéutica debido a sus propiedades químicas. Los analgésicos, como la paracetamol, contienen un grupo amida en su estructura. Además, las amidas están presentes en otros fármacos utilizados para tratar infecciones, enfermedades inflamatorias y como agentes antimicrobianos.
- Agroquímicos: Las amidas se emplean en la producción de diversos pesticidas, herbicidas y fungicidas. Estos compuestos son esenciales en la agricultura para el control de plagas y enfermedades, y a menudo contienen un grupo amida en su estructura para mejorar su estabilidad y efectividad.
- Industria textil: Los polímeros de amida como el nylon y otros derivados también se usan en la fabricación de tecidos sintéticos. Estos materiales son muy resistentes, duraderos y ligeros, lo que los convierte en una opción ideal para ropa y textiles industriales.
- Industria de cosméticos: Las amidas se utilizan en la formulación de productos cosméticos y de cuidado personal, como shampoos, lociones y cremas hidratantes, gracias a sus propiedades emolientes y su capacidad para estabilizar emulsiones.
- Fabricación de solventes y reactivos: Las amidas también se utilizan como solventes orgánicos en la industria química, y algunos compuestos aminados, como el dimetilformamida (DMF), son ampliamente utilizados como reactivos en la síntesis de otros productos químicos.
3. Nomenclatura de amidas
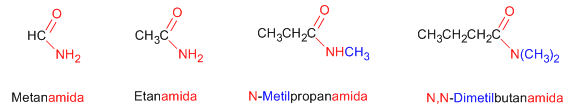
Regla 1. Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico del ácido por -amida.
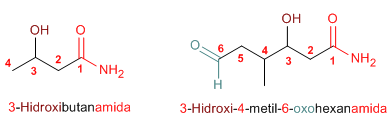
Regla 2. Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.
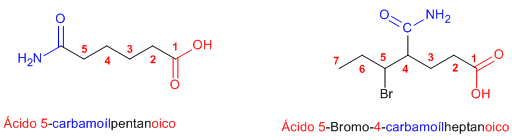
Regla 3. Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl…….
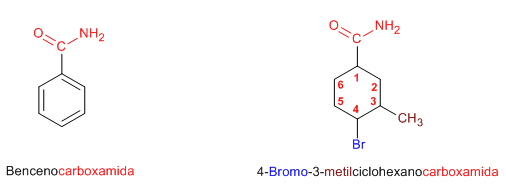
Regla 4. Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar el grupo amida.
Ejercicios de práctica
1. Escriba la nomenclatura para las siguientes estructuras:

2. Represente las estructuras condensadas para los siguientes compuestos:
a) N,N-dimetilacetamida
b) N-metilacetamida
c) N-eti-N-metilbenzamida
d) N-etil-3-metilciclopentanocarboxiamida
e) Diacetamida (dietanamida)
f) Dipropanamida
g) Triacetamida (trietanamida)
h) N-metildiacetamida
i) Ácido 2-carbamoilpropanoico
j) Triciclohexanocarboxamida
k) N-metilbenzamida
