En esta clase, vamos a explorar las sustancias puras, cómo se forman las moléculas y los compuestos, y aprenderemos a identificar diferentes tipos de sustancias químicas. Entender estos conceptos fundamentales nos ayudará a comprender mejor el mundo que nos rodea y cómo se organizan los materiales en la naturaleza.
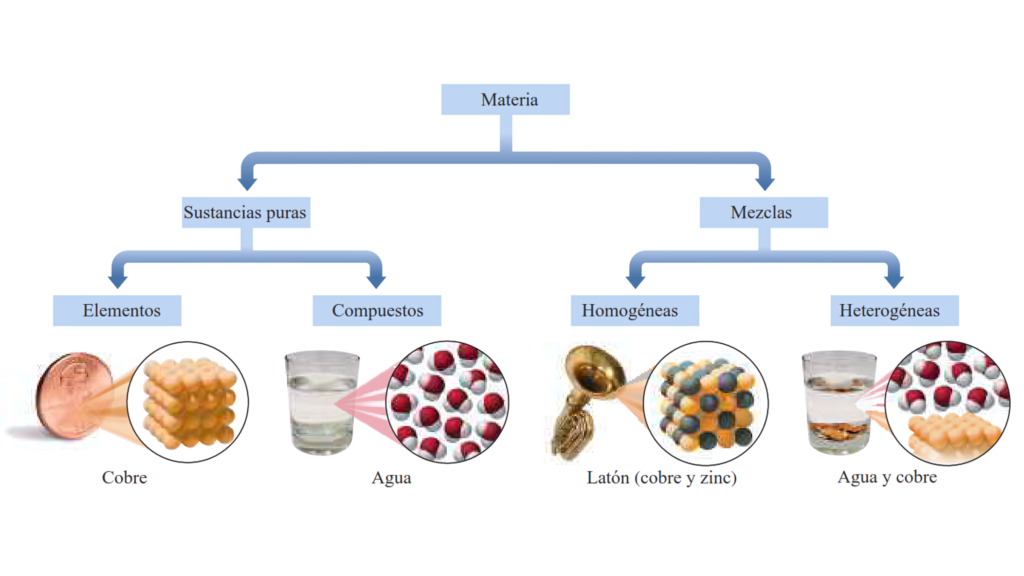
La materia está organizada por sus componentes: elementos, compuestos y mezclas.
Objetivo de aprendizaje
- Diferenciar entre elementos, compuestos y sustancias puras.
- Identificar ejemplos comunes de cada uno y comprender la importancia de las sustancias químicas en nuestra vida diaria.
1. Sustancia pura
Una sustancia pura es una forma de materia que tiene una composición constante y propiedades definidas. Está compuesta por un solo tipo de átomo o un solo tipo de molécula.
Una sustancia pura puede ser un elemento o un compuesto. El oxígeno, el hidrógeno y el sodio son ejemplos de sustancias puras.
Ejemplos de Sustancia Pura:
- Oxígeno (O₂): Un gas esencial para la respiración.
- Agua (H₂O): Un líquido vital para la vida.
- Sodio (Na): Un metal utilizado en diversas aplicaciones industriales.
2. Molécula
Una molécula es la partícula más pequeña de una sustancia que conserva sus propiedades químicas. Está formada por dos o más átomos unidos por enlaces químicos.
3. Compuesto
Un compuesto es una molécula que contiene al menos dos elementos (o átomos) diferentes que están combinados químicamente en una proporción fija.
El agua, representada por el símbolo químico H₂O, es un compuesto porque contiene dos elementos diferentes: hidrógeno (H) y oxígeno (O). La sal de mesa, representada por el símbolo químico NaCl, también es un compuesto porque contiene sodio (Na) y cloruro (Cl).
Otros ejemplos de compuestos:
- Dióxido de carbono (CO₂): Un gas producido durante la respiración y la combustión.
- Metano (CH₄): Un gas que se utiliza como combustible.
4. Sustancia química
Una sustancia química es cualquier material con una composición química definida. Pueden ser elementos, compuestos o mezclas.
Una sustancia química es algo que no se puede separar en sus componentes por métodos físicos. Por ejemplo, un diamante comienza como un trozo de carbón, pero fue sometido a un calor y presión intensos. Aunque cambia de forma de carbón a diamante, todavía está hecho de la misma sustancia: carbono.
Ejemplos de sustancias químicas:
- Ácido acético (CH₃COOH): un componente del vinagre.
- Glucosa (C₆H₁₂O₆): un tipo de azúcar que se encuentra en los alimentos.
- Bicarbonato de sodio (NaHCO₃): un compuesto que se usa en la cocina y en la limpieza.
Actividad: Adivina qué tipo de sustancia es
Materiales:
- Carteles con fórmulas químicas y nombres de compuestos.
Instrucciones:
- El maestro muestra una fórmula química y los estudiantes deben adivinar el nombre del compuesto o indicar qué tipo de sustancia es (elemento o compuesto).
- Ejemplos de sustancias: agua (H₂O), oxígeno (O₂), dióxido de carbono (CO₂), Oro (Au), cloruro de sodio (NaCl), nitrógeno (N₂), metano (CH₄), hierro (Fe).
