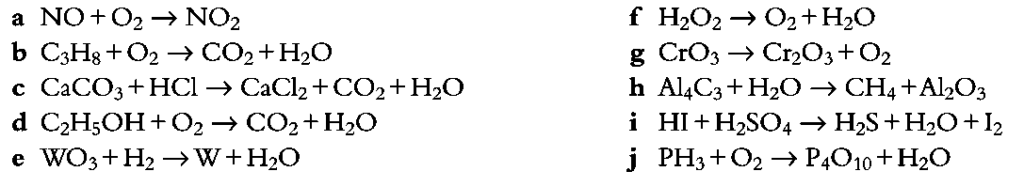El método de tanteo es una técnica en la que se ajustan los coeficientes de los reactivos y productos de manera sistemática hasta que la ecuación esté balanceada. Este método es especialmente útil para ecuaciones químicas sencillas y se basa en la inspección visual de los átomos de cada elemento en ambos lados de la ecuación.
Objetivo de aprendizaje
Aprender a balancear ecuaciones químicas utilizando el método de tanteo para asegurar la conservación de la masa en las reacciones químicas.
1. Pasos para balancear ecuaciones por tanteo:
- Escribir la ecuación no balanceada: Comienza escribiendo la ecuación química con las fórmulas correctas de los reactivos y productos.
- Contar los átomos de cada elemento en ambos lados: Identifica cuántos átomos de cada elemento están presentes en los reactivos y en los productos.
- Ajustar los coeficientes: Comienza balanceando los elementos que aparecen en una sola molécula en ambos lados de la ecuación. Luego, ajusta los elementos que están presentes en más de una molécula.
- Verificar el balanceo: Asegúrate de que el número de átomos de cada elemento sea el mismo en ambos lados de la ecuación.
- Simplificar los coeficientes: Si es posible, simplifica los coeficientes a los números enteros más bajos.
Ejemplo 1: Balancear la siguiente ecuación
N2 + H2 → NH3
- Paso 1: Contar los átomos de cada elemento en ambos lados.
- Reactivos: 2 N, 2 H
- Productos: 1 N, 3 H
- Paso 2: Ajustar el nitrógeno (N):
- N2 + H2 → 2NH3
- Ahora tenemos 2 N y 6 H en los productos.
- Ahora tenemos 2 N y 6 H en los productos.
- Paso 3: Ajustar el hidrógeno (H): N2 + 3H2 → 2NH3
- Ahora tenemos 2 N y 6 H en ambos lados, lo que balancea la ecuación.
Ejemplo 2: Balancear la siguiente ecuación
CH4 + O2 → CO2 + H2O
- Paso 1: Contar los átomos de cada elemento en ambos lados.
- Reactivos: 1 C, 4 H, 2 O
- Productos: 1 C, 2 H, 3 O
- Paso 2: Ajustar el hidrógeno (H): CH4 + O2 → CO2 + 2H2O
- Ahora tenemos 1 C, 4 H, 4 O en los productos.
- Ahora tenemos 1 C, 4 H, 4 O en los productos.
- Paso 3: Ajustar el oxígeno (O): CH4 + O2 → CO2 + 2H2O
- Ahora tenemos 1 C, 4 H, 4 O en ambos lados, lo que balancea la ecuación.
Balanceo con iones poliatómicos
Algunas veces, una ecuación contiene el mismo ion poliatómico tanto en los reactivos como en los productos. En ese caso, podemos balancear los iones poliatómicos como un grupo en ambos lados de la ecuación, como se muestra a continuación.
Ejemplo 3: Balancear la siguiente ecuación
H2SO4 + NaOH → Na2SO4 + H2O
Paso 1: Contar los átomos de cada elemento en ambos lados.
- Reactivos: 2 H, 1 SO₄ (que contiene 1 S y 4 O), 1 Na, 1 O (en NaOH)
- Productos: 2 Na, 1 SO₄, 2 H, 1 O (en H2O)
Paso 2: Balancear el sodio (Na): H2SO4 + 2NaOH → Na2SO4 + H2O
- Ahora tenemos 2 Na, 2 H, 1 SO₄, 2 O en los reactivos y 2 Na, 2 H, 1 SO₄, 2 O en los productos.
Paso 3: Verificar que todos los átomos estén balanceados.
- Como el ion poliatómico SO42− no se descompone en la reacción, se trata como una unidad, y la ecuación está balanceada.
Ejemplo 4: Balancear la siguiente ecuación
AgNO3 + NaCl → AgCl + NaNO3
Paso 1: Contar los átomos de cada elemento en ambos lados.
- Reactivos: 1 Ag, 1 NO₃ (que contiene 1 N y 3 O), 1 Na, 1 Cl
- Productos: 1 Ag, 1 Cl, 1 Na, 1 NO₃
Paso 2: Verificar el balanceo.
- Todos los elementos están balanceados, y como el ion poliatómico NO3− se conserva, la ecuación está balanceada.
Ejercicios de práctica
- Balancee las siguientes ecuaciones químicas por el método de tanteo (ensayo y error):