Los enlaces químicos son fundamentales para unir átomos y formar moléculas. Sin embargo, las propiedades de muchas sustancias no pueden explicarse únicamente por los enlaces químicos intramoleculares.
Las fuerzas intermoleculares son las atracciones débiles que se establecen entre moléculas y que determinan muchas de las propiedades físicas de las sustancias, como el punto de fusión, el punto de ebullición y la solubilidad. En esta clase exploraremos los diferentes tipos de fuerzas intermoleculares y su influencia en el comportamiento de las sustancias.
Objetivo de aprendizaje
- Comprender los diferentes tipos de fuerzas intermoleculares y explicar cómo estas influyen en las propiedades físicas de las sustancias.
1. ¿Qué son las fuerzas intermoleculares?
Las fuerzas intramoleculares (enlace iónicos, covalentes o metálicos) son aquellas que están presentes dentro de una molécula.
A diferencia de las fuerzas intramoleculares, las fuerzas intermoleculares son atracciones débiles que se establecen entre moléculas. Son mucho más débiles que los enlaces covalentes o iónicos, pero tienen un papel crucial en el comportamiento de la materia.
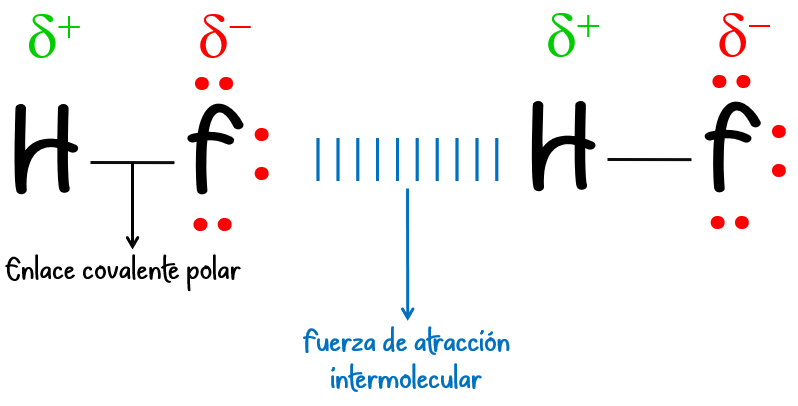
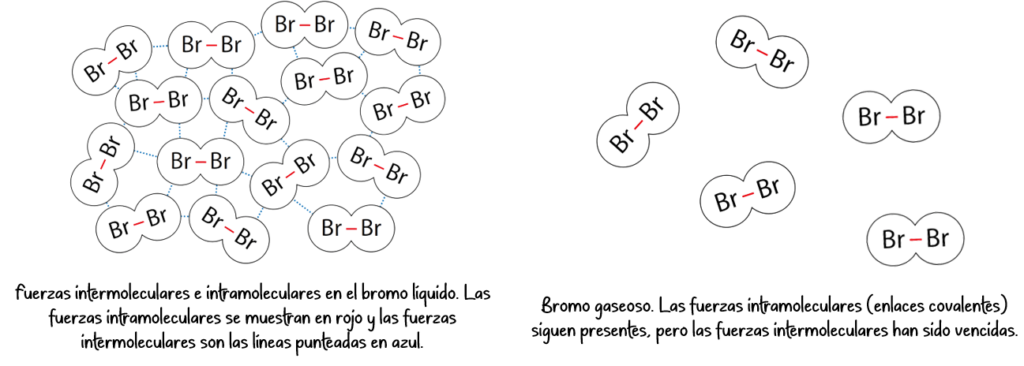
2. Tipos de fuerzas intermoleculares
Fuerzas de London (dispersión de London):
- Presentes en todas las moléculas, tanto polares como no polares.
- Se originan por la formación de dipolos instantáneos debido al movimiento aleatorio de los electrones.
- Son las fuerzas intermoleculares más débiles.
- La especie que es normalmente no polar, se puede volver fugazmente polar y formar un dipolo instantáneo. Además, por un proceso de inducción, este dipolo instantáneo puede provocar, a su vez, el desplazamiento de la nube electrónica de las nubes vecinas, formando lo que se conoce como un dipolo inducido.
- Ejemplos: Gases nobles, halógenos.
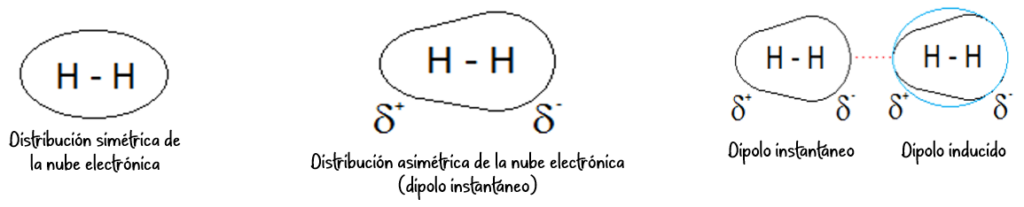
Fuerzas dipolo-dipolo:
- Se establecen entre moléculas polares.
- El extremo positivo de una molécula se atrae al extremo negativo de otra molécula.
- Son más fuertes que las fuerzas de London.
- Ejemplo: Cloruro de hidrógeno (HCl).
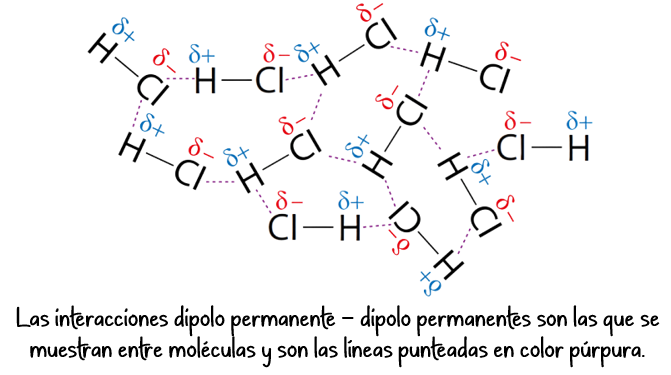
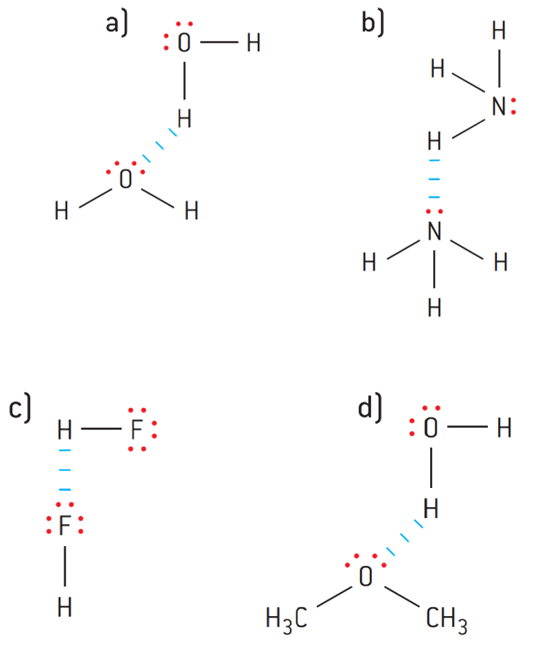
Puentes de hidrógeno:
- Se da entre moléculas donde existe un enlace H-F, O-H o N-H.
- Son las fuerzas intermoleculares más fuertes.
- Ejemplo: Agua (H₂O), amoníaco (NH₃).
- Ejemplo: Agua (H₂O), amoníaco (NH₃).
- Los puentes de hidrógeno, por ejemplo, se dan entre:
a) Moléculas de agua, H2O
b) Moléculas de amoníaco, NH3
c) Moléculas de fluoruro de hidrógeno, HF
d) Moléculas de agua y dimetil éter, CH3OCH3.
3. Influencia de las fuerzas intermoleculares en las propiedades físicas
- Punto de fusión y ebullición: Cuanto más fuertes sean las fuerzas intermoleculares, mayor será la energía necesaria para separar las moléculas y, por lo tanto, mayores serán los puntos de fusión y ebullición.
- Viscosidad: Las sustancias con fuertes fuerzas intermoleculares suelen ser más viscosas.
- Tensión superficial: La tensión superficial del agua, por ejemplo, se debe a los puentes de hidrógeno.
- Solubilidad: Las sustancias polares tienden a disolverse en solventes polares debido a las fuerzas dipolo-dipolo y los puentes de hidrógeno.
4. Factores que afectan las fuerzas intermoleculares
- Tamaño molecular: A medida que aumenta el tamaño de la molécula, aumentan las fuerzas de London.
- Forma molecular: La forma de la molécula influye en la capacidad de las moléculas para acercarse y establecer fuerzas intermoleculares.
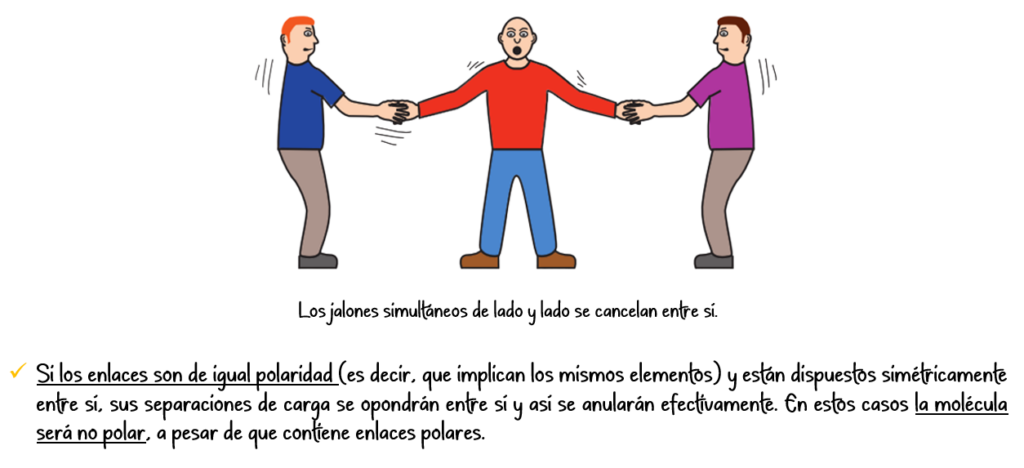
- Polaridad: La polaridad de la molécula determina el tipo de fuerzas intermoleculares que se pueden establecer.
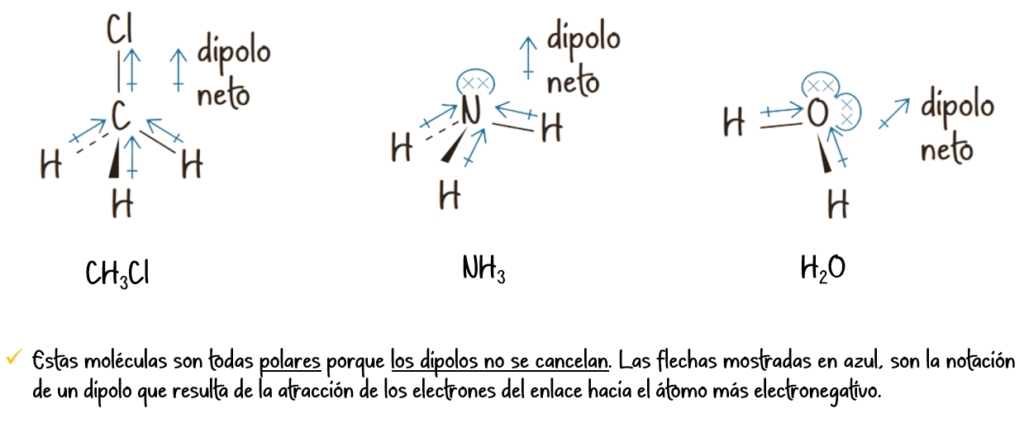
5. Polaridad de las moléculas
La polaridad de un enlace covalente depende de la diferencia de electronegatividad entre los átomos que lo forman. La electronegatividad es la capacidad de un átomo para atraer hacia sí los electrones de un enlace.
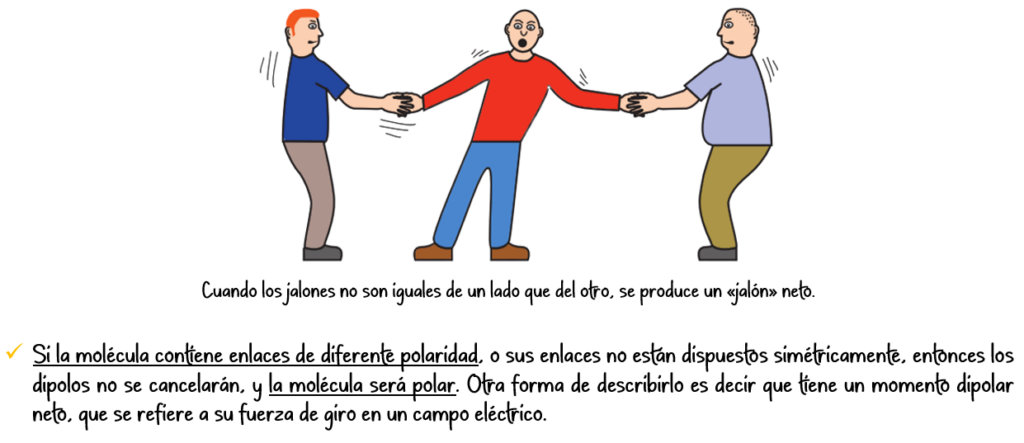
Enlace covalente polar:
Se forma entre átomos con diferente electronegatividad. El par de electrones compartido se encuentra más cerca del átomo más electronegativo, generando una distribución de carga asimétrica y formando un dipolo.
Ejemplo: La molécula de agua (H₂O), donde el oxígeno es más electronegativo que el hidrógeno.
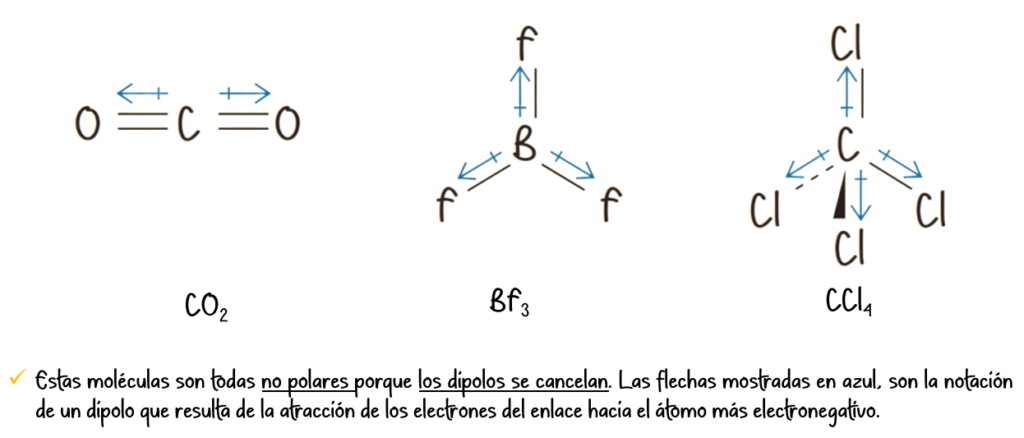
Enlace covalente no polar:
Se forma entre átomos con igual o muy similar electronegatividad. El par de electrones compartido se encuentra en el punto medio entre los núcleos, generando una distribución de carga simétrica.
Ejemplo: La molécula de hidrógeno (H₂).
Influencia de la polaridad en las propiedades:
La polaridad de un enlace influye en las propiedades físicas y químicas de las sustancias, como:
- Punto de fusión y ebullición: Las moléculas polares tienen fuerzas intermoleculares más fuertes, lo que se traduce en puntos de fusión y ebullición más altos.
- Solubilidad: Las sustancias polares tienden a disolverse en solventes polares, mientras que las sustancias no polares se disuelven en solventes no polares.
- Conductividad eléctrica: Las sustancias con enlaces covalentes polares pueden ser conductoras de electricidad cuando se disuelven en agua, formando iones.
Actividad
- Identifique cuál de las siguientes moléculas son polares o no polares:
- CO2
- C2H2
- HCl
- H2O
- BF3
- SCl2
- PCl3
- SO3
