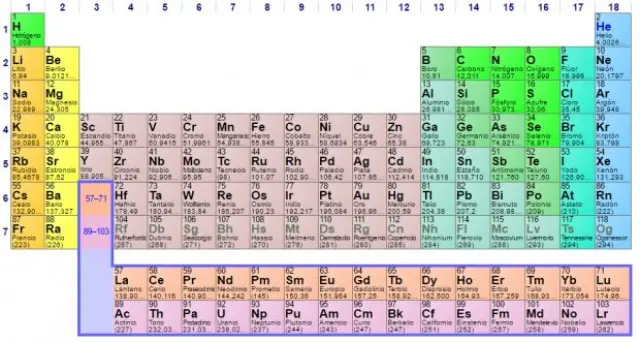
La tabla periódica es una herramienta esencial en la química que organiza todos los elementos químicos conocidos. Su desarrollo a lo largo del tiempo ha sido fundamental para entender cómo se comportan los elementos y cómo interactúan entre sí. En esta clase, exploraremos cómo se creó esta herramienta que evolucionó hasta convertirse en lo que usamos hoy en día.
Objetivo de aprendizaje
- Conocer la evolución histórica de la tabla periódica y su importancia en la química.
1. Primeros intentos de clasificación de elementos
- Lavoisier (1789): Considerado el “padre de la química moderna”, Antoine Lavoisier fue uno de los primeros en listar los elementos químicos conocidos en ese momento, clasificándolos en metales, no metales, tierras y gases.
- Dobereiner (1829): Johann Wolfgang Döbereiner propuso las “triadas de Döbereiner”. El mismo, consiguió elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades. Él destaca la existencia de similitudes entre elementos agrupados en tríos que denomina “tríadas”. La tríada del cloro, del bromo y del yodo es un ejemplo.

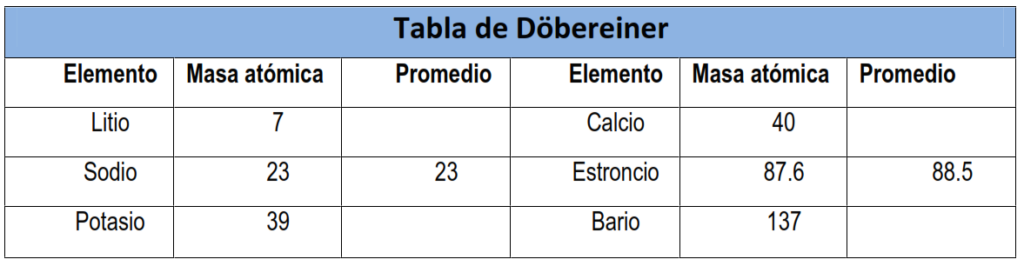
A la izquierda, clasificación de las sustancias simples. Lavoisier (1789). A la derecha, las Octavas de Dobereiner.
2. La ley de las Octavas y la tabla de Newlands
- Newlands (1864): John Newlands formuló la ley de las Octavas, que sugería que los elementos se organizaban en grupos de ocho según sus propiedades químicas, similar a las octavas musicales. Esta idea, aunque innovadora, tenía limitaciones.
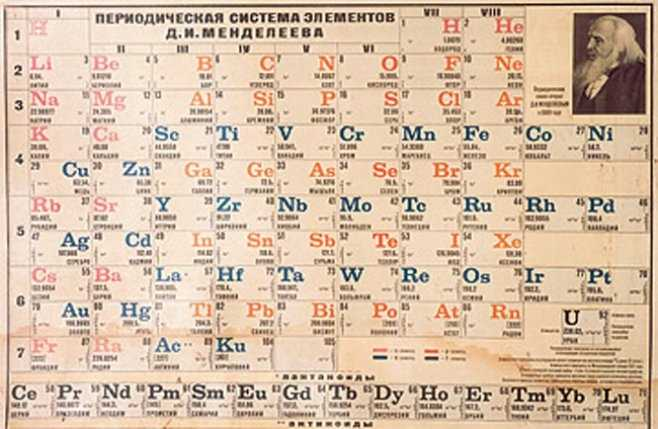
3. La tabla periódica de Mendeleiev
- Mendeléiev (1869): Dmitri Mendeléiev organizó una tabla periódica que agrupaba elementos según su masa atómica y propiedades químicas. Su tabla dejó espacios para elementos aún no descubiertos, prediciendo sus propiedades con sorprendente precisión.
La tabla de Mendeléiev permitió hacer predicciones sobre elementos desconocidos y su disposición llevó a un mejor entendimiento de las relaciones entre los elementos.
4. La tabla periódica moderna y la ley periódica de Moseley
- Moseley (1913): Henry Moseley descubrió que el número atómico, y no la masa atómica, era el mejor criterio para organizar los elementos. Este hallazgo permitió corregir algunas inconsistencias en la tabla y condujo a la tabla periódica moderna.
La tabla periódica sigue evolucionando a medida que se descubren nuevos elementos y se profundiza el conocimiento sobre la estructura atómica.
5. Estructura actual de la tabla periódica
- Grupos y períodos: La tabla periódica está organizada en filas llamadas períodos y columnas llamadas grupos. Los elementos en el mismo grupo tienen propiedades químicas similares.
- Bloques y categorías: Los elementos se agrupan en bloques (s, p, d, f) y categorías como metales, no metales y metaloides.