El dominio de los cálculos usando la masa molar es esencial para comprender las reacciones químicas y la relación entre la masa de los compuestos y sus elementos. Los estudiantes aprenderán a realizar conversiones precisas que son fundamentales para el trabajo en el laboratorio.
Objetivos de aprendizaje
- Utilizar la masa molar para convertir entre gramos y moles.
- Utilizar la masa molar para convertir entre gramos y número de partículas.
- Utilizar la masa molar para convertir entre gramos de un compuesto y gramos de un elemento.
1. Conversión de gramos a moles
- Para convertir masa a moles, usamos la masa molar del elemento:
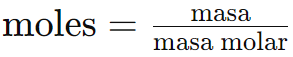
Ejemplo 1: ¿Cuántos moles hay en 50 gramos de oxígeno (O)?
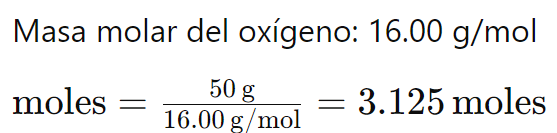
- Para convertir moles a masa, multiplicamos los moles por la masa molar:
masa = moles × masa molar
Ejemplo 2: ¿Cuántos gramos hay en 2 moles de carbono (C)?
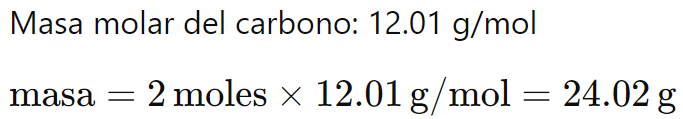
2. Conversión masa – número de Avogadro
- Para convertir masa a número de moléculas, primero convertimos la masa a moles y luego usamos el número de Avogadro:
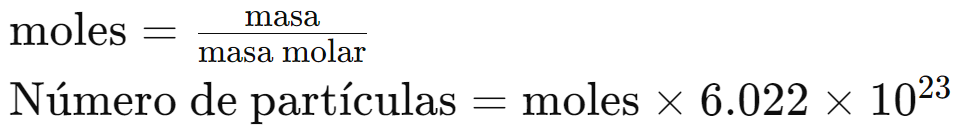
Ejemplo 3: ¿Cuántas moléculas hay en 18 gramos de agua (H2O)?
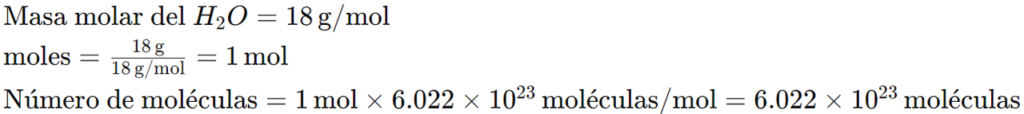
- Para convertir número de moléculas a masa, primero convertimos las moléculas a moles y luego multiplicamos por la masa molar:
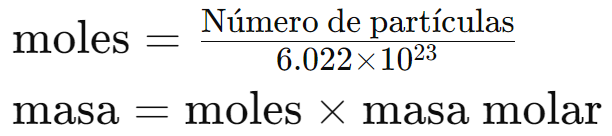
Ejemplo 4: ¿Cuántos gramos hay en 1.2044 × 1024 moléculas de agua (H2O)?
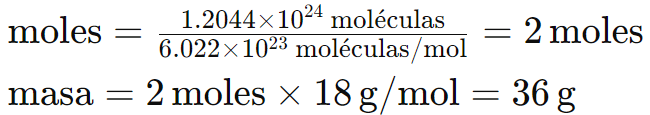
3. Conversión entre la masa de un compuesto y la masa de un elemento
- Para convertir la masa de un compuesto a la masa de uno de sus elementos, se siguen estos pasos:
- Calcular la masa molar del compuesto.
- Calcular el número de moles del compuesto.
- Usar la proporción estequiométrica para encontrar la masa del elemento.
Ejemplo 5: ¿Cuánta masa de oxígeno hay en 50 gramos de H2O?
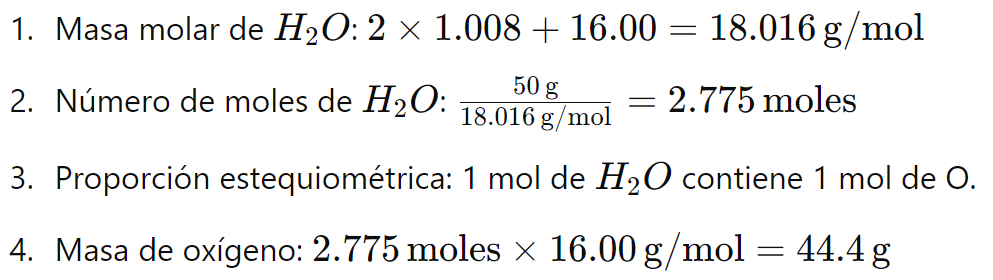
- Para convertir la masa de un elemento a la masa del compuesto, se siguen estos pasos:
- Calcular el número de moles del elemento.
- Usar la proporción estequiométrica para encontrar el número de moles del compuesto.
- Calcular la masa del compuesto.
Ejemplo 6: ¿Cuánta masa de H2O se puede formar con 32 gramos de oxígeno?
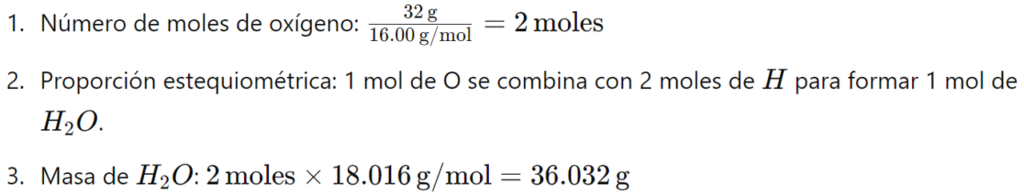
Ejercicios de práctica
1. Resuelve los siguientes problemas:
a) ¿Cuántos moles hay en 88 g de Au?
b) ¿Cuántos gramos de vanadio hay en 0,35 mol de ese elemento?
c) ¿Cuántas moléculas hay en 3 moles de CO2?
d) ¿Cuántos átomos hay en 0,5 moles de He?
e) ¿Cuántos moles hay en 1,2044 × 1024 moléculas de O2?
f) ¿Cuántos moles hay en 2,409 × 1024 átomos de H?
g) ¿Cuántas moléculas hay en 44 gramos de CO2?
h) ¿Cuántos átomos hay en 1 gramo de H2?
i) ¿Cuántos gramos hay en 3,011 × 1023 moléculas de N2?
j) ¿Cuántos gramos hay en 6,022 × 1022 átomos de Na?
k) ¿Cuánta masa de hidrógeno hay en 36 gramos de CH4?
l) ¿Cuánta masa de carbono hay en 44 gramos de CO2?
m) ¿Cuánta masa de NH3 se puede formar con 28 gramos de nitrógeno?
n) ¿Cuánta masa de NaCl se puede formar con 23 gramos de sodio?
