La fórmula empírica y la fórmula molecular son herramientas fundamentales en química que permiten expresar la composición de los compuestos químicos. Mientras que la fórmula empírica proporciona la proporción más simple de los elementos en un compuesto, la fórmula molecular indica el número exacto de átomos de cada elemento en una molécula.
Objetivo de aprendizaje
- Comprender y diferenciar la fórmula empírica y la fórmula molecular de los compuestos químicos.
1. Fórmula Empírica
La fórmula empírica es la representación más simple de la proporción de los elementos en un compuesto. Muestra la relación mínima de números enteros entre los átomos de los elementos en el compuesto.
Ejemplo 1: Los compuestos que contienen azufre y oxígeno son graves contaminantes del aire y son la causa principal de la lluvia ácida. El análisis de un compuesto puro indica que contiene el 50,1% de azufre y el 49,9% de oxígeno en masa. ¿Cuál es la fórmula empírica del compuesto?
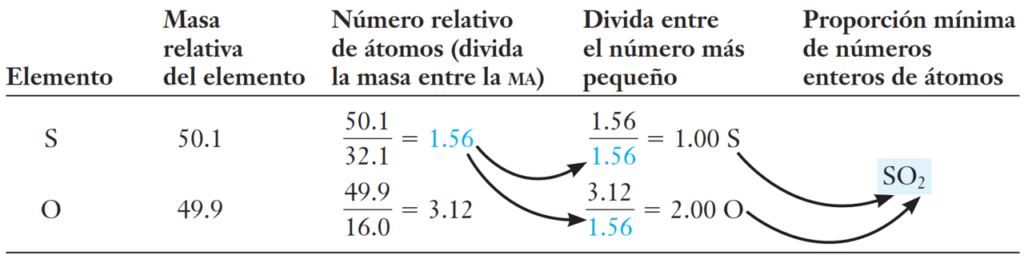
Ejemplo 2: Una muestra de 20,882 g de un compuesto iónico contiene 6,072 g de Na, 8,474 g de S y 6,336 g de O. Determine su fórmula empírica.

2. Fórmula molecular
La fórmula molecular indica el número real de átomos de cada elemento en una molécula de un compuesto. Para determinar la fórmula molecular a partir de la fórmula empírica, se necesita conocer la masa molar del compuesto.
En muchos compuestos, la fórmula molecular es un múltiplo de la fórmula mínima. Consideremos el butano, C4H10, cuya fórmula empírica es C2H5; no obstante, su fórmula molecular tiene el doble de átomos; esto es, 2 × (C2H5) = C4H10. El benceno, C6H6, es otro ejemplo. La fórmula mínima del benceno es CH, pero su fórmula molecular tiene seis veces más esos átomos; esto es, 6 × (CH) = C6H6.
La fórmula molecular de un compuesto es igual a, o es un múltiplo entero de, su fórmula
empírica.
fórmula molecular = n × fórmula empírica
De modo que podemos escribir

Entonces, la fórmula molecular se obtiene multiplicando la fórmula empírica por el entero n.
Ejemplo 3: Una muestra de glucosa se analizó y arrojó los siguientes resultados: 0,04055 g de C; 0,00681 g de H y 0,0540 g de O. Otros experimentos indican que su masa molecular es aproximadamente de 180 uma. Determine las fórmulas mínima y molecular de la glucosa.
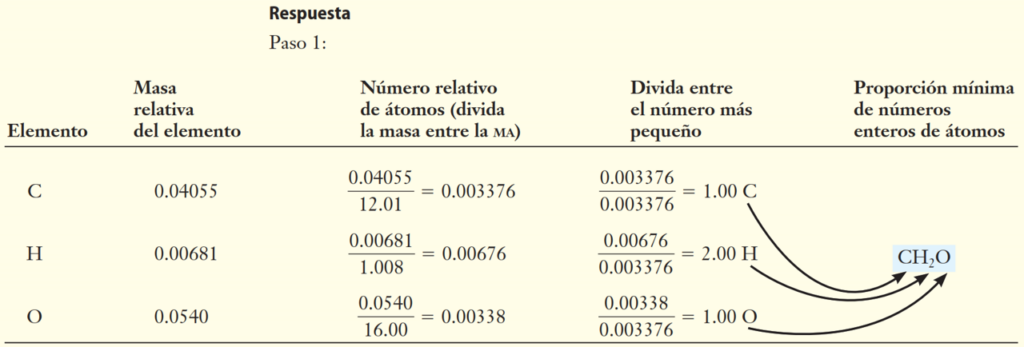

La fórmula empírica y la fórmula molecular son esenciales para comprender la composición de los compuestos químicos. La fórmula empírica proporciona la proporción más simple de los elementos, mientras que la fórmula molecular muestra el número exacto de átomos de cada elemento en una molécula. Aprender a determinar estas fórmulas es fundamental para el estudio de la química y la comprensión de las propiedades de los compuestos.
Ejercicios de práctica
1. Calcula la fórmula empírica para cada uno de los siguientes casos:
a) 3,57 g de N y 2,04 g de O
b) 7,00 g de C y 1,75 g de H
c) 0,175 g de H; 2,44 g de N y 8,38 g de O
d) 2,06 g de Ca; 2,66 g de Cr y 3,28 g de O
2. Calcula la fórmula empírica para cada uno de los siguientes casos:
a) 70,9% K y 29,1% S
b) 55,0% Ga y 45,0% F
c) 69,6% Mn y 30,4% O
d) 18,8% Li; 16,3% C y 64,9% O
e) 51,7% C; 6,95% H y 41,3% O
3. Escribe la fórmula empírica para cada una de las siguientes sustancias:
a) H₂O₂, peróxido.
b) C₁₈H₁₂, criseno, usado en la fabricación de tintes.
c) C₁₀H₁₆O₂, ácido crisantémico, en flores de piretro.
d) C₉H₁₈N₆, altretamina, medicamento contra el cáncer.
e) C₂H₄N₂O₂, oxamida, fertilizante.
4. El carbohidrato fructosa que se encuentra en la miel y las frutas tiene una fórmula empírica de CH₂O. Si la masa molar experimental de la fructosa es de 180 g, ¿cuál es su fórmula molecular?
5. El ácido vanílico contiene 57,14% C; 4,80% H y 38,06% O, y tiene una masa molar experimental de 168 g. ¿Cuál es la fórmula molecular del ácido vanílico?
