En muchos casos, los reactivos no están en su forma pura, lo que significa que contienen impurezas que pueden afectar el resultado de una reacción. Entender cómo calcular la pureza de un reactivo permite ajustar las cantidades utilizadas y obtener resultados más precisos.
Objetivo de aprendizaje
- Calcular la pureza de un reactivo y aplicar este conocimiento en situaciones prácticas.
1. Pureza de un reactivo
La pureza de un reactivo se refiere a la proporción del reactivo que es químicamente puro, en comparación con la cantidad total que incluye impurezas.
Se expresa generalmente como un porcentaje y es crucial para determinar la cantidad real de sustancia pura que está disponible para reaccionar.
La pureza es un factor importante en la preparación de soluciones, en la fabricación de productos químicos y en cualquier proceso donde la precisión en la cantidad de reactivos es necesaria.
La fórmula general para calcular la pureza es:
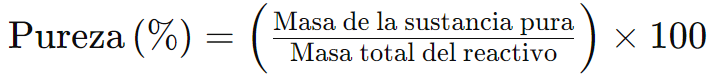
Ejemplo 1: Supongamos que tienes 10,0 g de un reactivo que contiene 8,5 g de sustancia pura y 1,5 g de impurezas. Para calcular la pureza del reactivo:
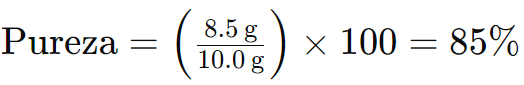
Esto significa que el reactivo tiene una pureza del 85%, es decir, el 85% de la masa total es la sustancia pura, mientras que el 15% restante son impurezas.
Ejemplo 2: En un experimento, necesitas 5,0 g de cloruro de sodio (NaCl) puro, pero solo dispones de cloruro de sodio con una pureza del 90%. Debes calcular cuánta masa de este reactivo necesitas para obtener los 5,0 g de NaCl puro.
Primero, usando la fórmula de pureza:
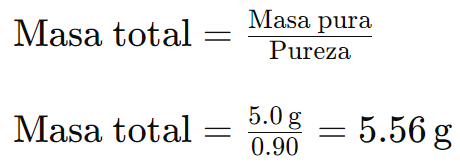
Necesitas 5,56 g de cloruro de sodio con una pureza del 90% para obtener los 5,0 g de NaCl puro.
Ejemplo 3: Tienes 25,0 g de un reactivo con una pureza del 95%. Determina la cantidad de sustancia pura y la cantidad de impurezas presentes.
Para calcular la masa de la sustancia pura:
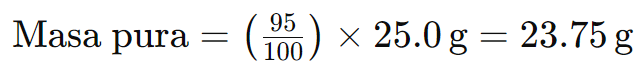
La masa de impurezas sería:
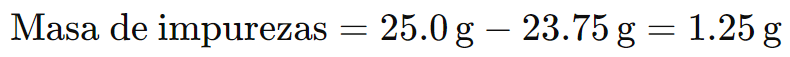
Por lo tanto, el reactivo contiene 23,75 g de sustancia pura y 1,25 g de impurezas.
Ejemplo 3:

Ejercicios de práctica
1.
a) ¿Qué masa de carbonato de magnesio hay en 275 gramos de una mena que contiene 26,7% de carbonato de magnesio en masa?
b) ¿Qué masa de la muestra son impurezas?
c) ¿Qué masa de magnesio contiene la muestra? (Considere que en las impurezas no hay magnesio.)
2. El vinagre tiene 5,0% en masa de ácido acético, C2H4O2. ¿Cuántos gramos de ácido acético hay en 143,7 g de vinagre?
3. ¿Cuántos gramos de cloruro de sodio, NaCl, hay en 34,0 g de una salmuera que tiene 5,0% de NaCl en masa?
