
La ley de la conservación de la masa, formulada por Antoine Lavoisier en el siglo XVIII, es fundamental para entender y balancear las ecuaciones químicas, lo cual es esencial en el estudio de la química.
Objetivo de aprendizaje
- Comprender y aplicar la ley de la conservación de la masa en reacciones químicas.
1. Ley de conservación de la masa
La ley de la conservación de la masa es uno de los principios fundamentales de la química. Esta ley establece que la masa total de los reactivos en una reacción química es igual a la masa total de los productos. Es decir, en cualquier reacción química, la masa no se crea ni se destruye, solo se transforma. Este principio es crucial para el balanceo de ecuaciones químicas y para entender cómo se relacionan las cantidades de reactivos y productos en una reacción.

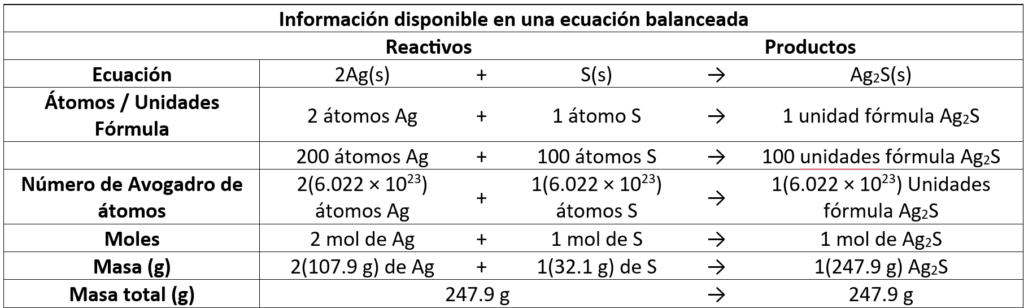
En esta reacción, el número de átomos de plata que reacciona es el doble del número de átomos de azufre. Cuando reaccionan 200 átomos de plata, se requieren 100 átomos de azufre. Sin embargo, en la reacción química real, muchos más átomos de plata y de azufre reaccionarían. Si estamos tratando con cantidades molares, entonces los coeficientes en la ecuación pueden interpretarse en términos de moles. Así, 2 moles de plata reaccionan con 1 mol de azufre para producir 1 mol de Ag2S. Como se puede determinar la masa molar de cada uno, las moles de Ag, S y Ag2S también pueden expresarse en términos de masa en gramos de cada uno. Así, 215,8 g de Ag y 32,1 g de S reaccionan para formar 247,9 g de Ag2S. La masa total de los reactivos (247,9 g) es igual a la masa del producto (247,9 g).
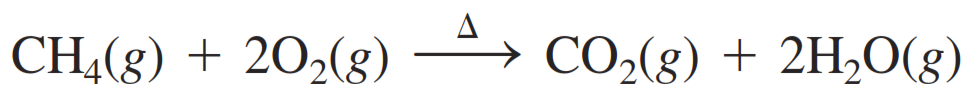
Ejemplo 1: La combustión del metano (CH₄) con oxígeno produce dióxido de carbono, agua y energía. Calcula la masa total de los reactivos y los productos para la siguiente ecuación cuando 1 mol de CH₄ reacciona:
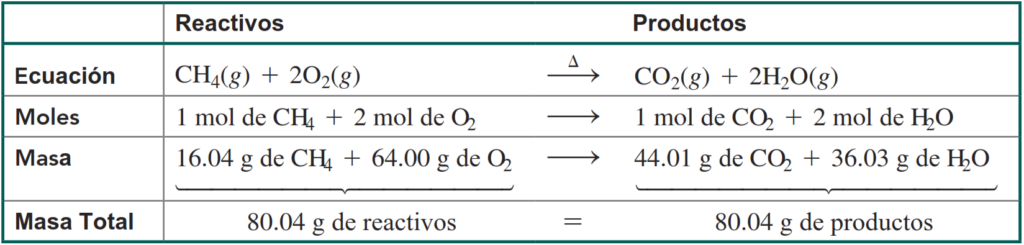
Solución:
Interpretar los coeficientes en la ecuación como el número de moles de cada sustancia y multiplicar por su masa molar da la masa total de reactivos y productos. Las cantidades de moles son exactas porque los coeficientes en la ecuación balanceada son exactos.
Ejercicios de práctica
1. Calcula la masa total de los reactivos y los productos para cada una de las siguientes ecuaciones:
a) 2SO2(g) + O2(g) → 2SO3(g)
b) 4P(s) + 5O2(g) → 2P2O5(s)
c) 2Al(s) + 3Cl2(g) → 2AlCl3(s)
d) 4HCl(g) + O2(g) → 2Cl2(g) + 2H2O(g)
