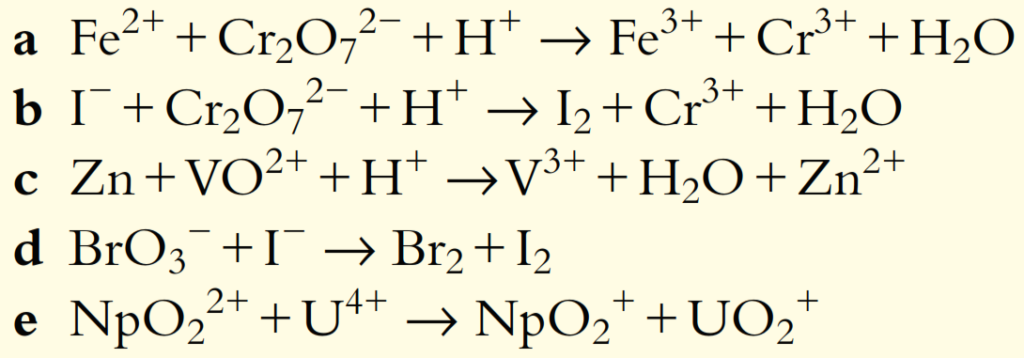Las reacciones redox, también conocidas como reacciones de oxidación-reducción, son procesos fundamentales en química, donde se produce la transferencia de electrones entre especies químicas. El balanceo de ecuaciones redox es crucial para entender cómo se conservan los átomos y la carga eléctrica durante estas reacciones. El método de balanceo por redox implica identificar las semirreacciones de oxidación y reducción y luego combinarlas de manera que se conserve tanto la masa como la carga.
Objetivo de aprendizaje
- Aprender a identificar reacciones redox y balancear ecuaciones químicas utilizando el método redox, asegurando la conservación de masa y carga en el proceso.
1. Oxidación y Reducción
Oxidación:
Es el proceso mediante el cual una especie química pierde electrones. Durante la oxidación, el estado de oxidación de un elemento aumenta.
Ejemplo: la oxidación del Zinc.
Zn → Zn2+ + 2e−
En esta reacción, el zinc (Zn) pierde dos electrones, lo que resulta en la formación de un ion Zn2+.
Reducción:
Es el proceso mediante el cual una especie química gana electrones. Durante la reducción, el estado de oxidación de un elemento disminuye.
Ejemplo: la reducción del cobre(II).
Cu2+ + 2e− → Cu
Aquí, el ion cobre(II) (Cu2+) gana dos electrones, convirtiéndose en cobre metálico (Cu).
2. Semiecuaciones
En una reacción redox, la ecuación completa se puede dividir en dos semiecuaciones: una que representa la oxidación y otra la reducción.
Procedimiento para escribir semiecuaciones:
- Identificar las especies que se oxidan y se reducen.
- Escribir las semiecuaciones para cada proceso.
- Balancear todos los átomos excepto el oxígeno y el hidrógeno.
- Balancear el oxígeno añadiendo H2O.
- Balancear el hidrógeno añadiendo H+.
- Balancear la carga añadiendo electrones.
Por ejemplo, dada la ecuación:
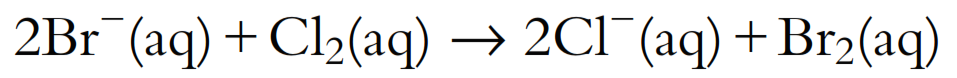
Podemos separarlo en dos procesos:

Ejemplo 1:
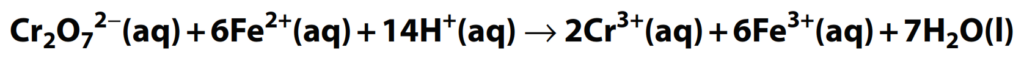
Esta reacción puede separarse en dos semiecuaciones:
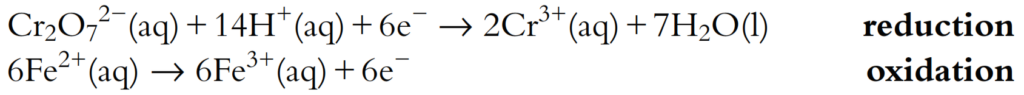
La segunda semiecuación se puede simplicar a:

Ejemplo 2:
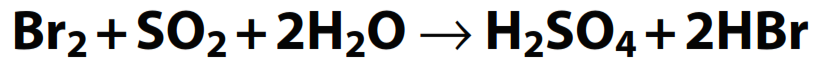
Esta reacción se puede separar en:
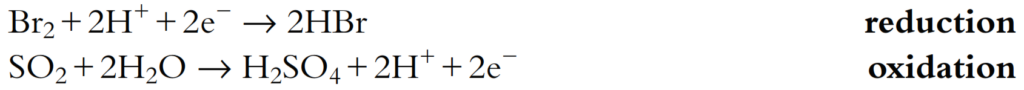
Se puede ver que todas estas semiecuaciones están balanceadas, tanto en términos del número de átomos en ambos lados como de la carga total en ambos lados. Esto debe ser cierto para todas las semiecuaciones.
También se debe tener en cuenta que el número de electrones perdidos en la reacción de oxidación es igual al número de electrones ganados en la reacción de reducción. Esto debe ser cierto porque los electrones no pueden simplemente desaparecer o ser creados de la nada.
3. Balanceo de semiecuaciones en soluciones neutras
Las semiecuaciones deben estar balanceadas en términos del número de átomos en ambos lados y en términos de la carga total en ambos lados. En algunos casos, es muy sencillo balancear semiecuaciones, y los electrones deben simplemente añadirse a un lado o al otro.
Por ejemplo, consideremos la siguiente semiecuación:
Ni2+→Ni
Aunque el número de átomos de níquel en cada lado es el mismo, la carga total en el lado izquierdo es 2+ pero la carga total en el lado derecho es 0. Para balancear las cargas, debemos añadir 2e− al lado izquierdo:
Ni2+ + 2e− → Ni
Ahora, el número de átomos y las cargas están balanceados en cada lado.
Ahora, veamos otra semiecuación:
Br2 → Br−
En este ejemplo, ni el número de átomos ni la carga total están balanceados. Primero, balanceamos los átomos para obtener:
Br2 → 2Br−
La carga total en el lado izquierdo es cero, pero en el lado derecho es 2−. Para balancear las cargas, necesitamos añadir 2e− al lado izquierdo para que la carga sea igual en ambos lados:
Br2 + 2e−→ 2Br−
Ahora está balanceado.
Estos fueron ejemplos bastante sencillos, pero el proceso se vuelve un poco más difícil en algunos casos; ahora consideraremos el balanceo de semiecuaciones más complejas para reacciones en solución ácida.
4. Balanceo de semiecuaciones en solución ácida
Se debe cumplir el siguiente procedimiento para balancear estas ecuaciones:
- Balancear todos los átomos excepto H y O.
- Añadir H2O al lado deficiente en O para balancear el oxígeno.
- Añadir H+ al lado deficiente en H para balancear el hidrógeno.
- Añadir e− al lado deficiente en carga negativa para balancear la carga.
Ejemplo:
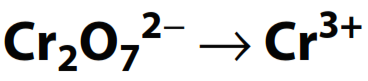
- Balancear todos los átomos excepto H y O: Los átomos de Cr deben estar balanceados:
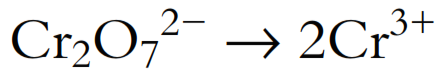
- Añadir H2O al lado deficiente en O para balancear el oxígeno: Hay 7 átomos de O en el lado izquierdo y ninguno en el lado derecho, por lo que deben añadirse 7 moléculas de H2O al lado derecho:
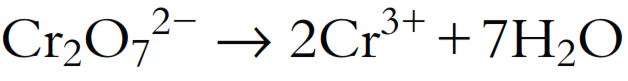
- Añadir H+ al lado deficiente en H para balancear el hidrógeno: Hay 14 átomos de H en el lado derecho, pero ninguno en el lado izquierdo, por lo que deben añadirse 14 iones H+ al lado izquierdo:
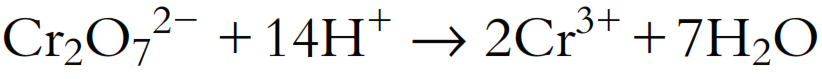
- Añadir e− al lado deficiente en carga negativa para balancear la carga: La carga total en el lado izquierdo es 2- + 14+ = 12+, y la carga total en el lado derecho es 2 × 3+ = 6+, por lo que deben añadirse 6 electrones 6e− al lado izquierdo para balancear las cargas:
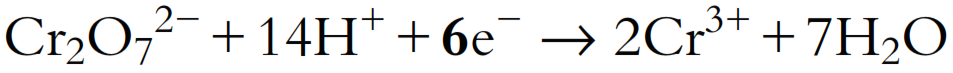
La carga total en el lado izquierdo ahora es 2- + 14+ + 6- = 6+, lo cual es igual a la carga total en el lado derecho.
5. Combinación de semiecuaciones para producir una ecuación redox general
Una semiecuación de oxidación puede combinarse con una semiecuación de reducción para producir una ecuación redox general. Cuando se combinan las semiecuaciones, el número de electrones perdidos en la reacción de oxidación debe ser el mismo que el número de electrones ganados en la reacción de reducción.
Consideremos las siguientes dos semiecuaciones:
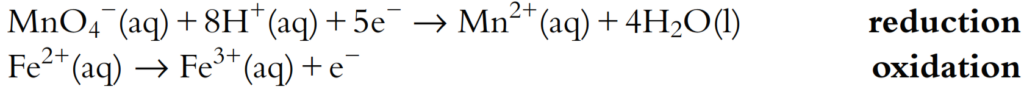
Cinco electrones se ganan en la semiecuación de reducción, pero solo se pierde uno en la semiecuación de oxidación. Por lo tanto, la semiecuación de oxidación debe multiplicarse por 5:
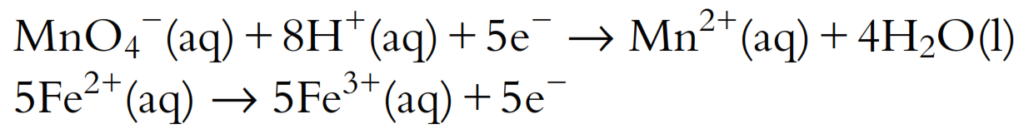
Ahora el número de electrones está balanceado y las dos semiecuaciones pueden sumarse:
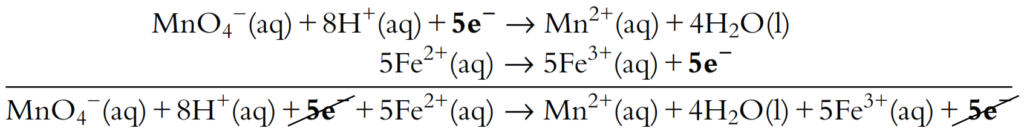
Los electrones se cancelan de ambos lados para obtener la ecuación redox general.
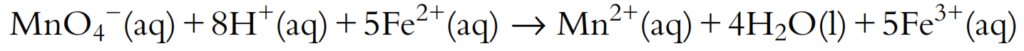
Una verificación final se puede realizar para confirmar que la ecuación está efectivamente balanceada, comprobando que el número de átomos de cada tipo sea el mismo en ambos lados y también que la carga total sea la misma en ambos lados.
6. Balanceo de ecuaciones redox para reacciones en solución ácida o neutra
Podemos combinar las técnicas anteriores para balancear ecuaciones redox globales. La ecuación se divide primero en dos ecuaciones parciales, que se balancean por separado y luego se combinan para obtener la ecuación redox general. El procedimiento para hacer esto es el siguiente:
- Separar la ecuación de reacción en semiecuaciones de oxidación y reducción.
- Balancear cada semiecuación por separado.
- Combinar las dos semiecuaciones después de multiplicarlas por los números apropiados para balancear los electrones en cada una.
- Restar las duplicaciones en los lados izquierdo y derecho.
Ejemplo:
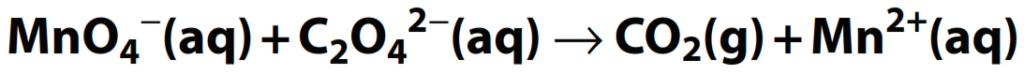
Balancea la ecuación de reacción redox anterior, que ocurre en solución ácida. Las dos ecuaciones parciales son:

- Balancea todos los átomos excepto H y O:

- Añadir H₂O al lado deficiente en O para balancear el O:

- Añadir H⁺ al lado deficiente en H para balancear el H:

- Añadir e⁻ al lado deficiente en carga negativa para balancear la carga:
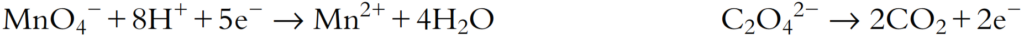
- Estos deben combinarse de manera que los electrones se balanceen. Esto se logra multiplicando la semiecuación de reducción por 2 y la semiecuación de oxidación por 5:
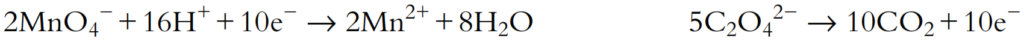
Los números de electrones ahora están balanceados. Las dos semiecuaciones se suman y los electrones se cancelan:
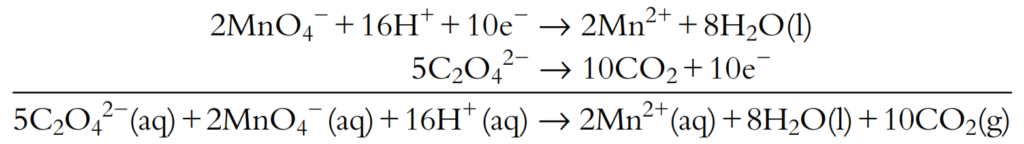
No hay especies iguales en ambos lados, por lo que esta es la ecuación final.
Ejercicios de práctica
1. Balancee las siguientes semiecuaciones para reacciones que ocurren en solución neutra:
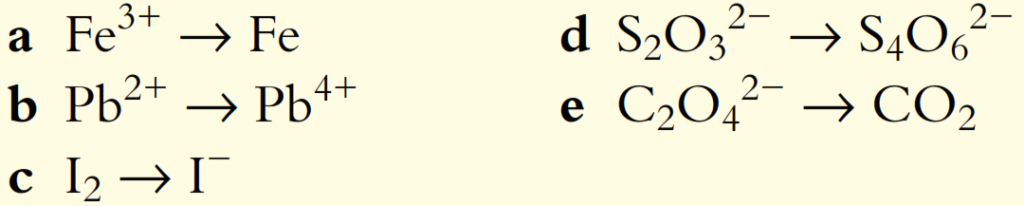
2. Balancee las siguientes semiecuaciones para reacciones que ocurren en solución ácida:
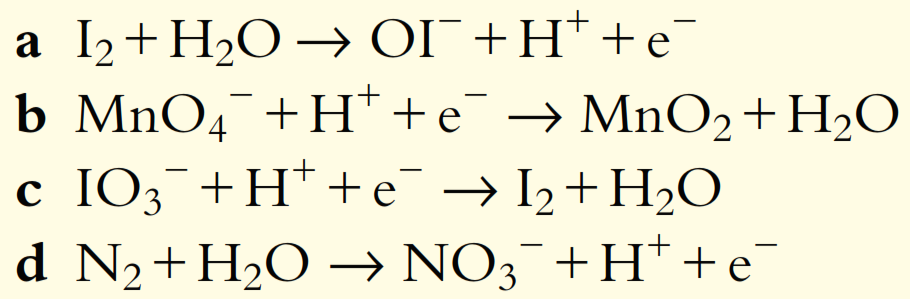
3. Balancee las siguientes semiecuaciones para reacciones que ocurren en solución ácida:
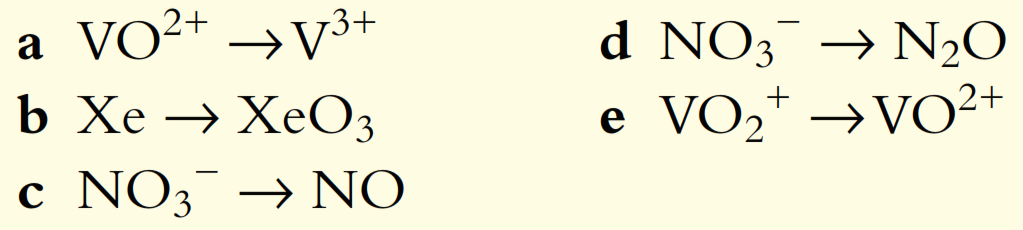
4. Balancee las siguientes ecuaciones redox para reacciones que ocurren en solución neutra:
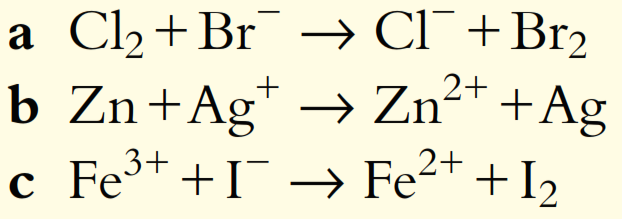
5. Balancee las siguientes ecuaciones redox para reacciones que ocurren en solución ácida: