
Imagina que estás preparando sándwiches para una fiesta. Para cada sándwich, necesitas 2 rebanadas de pan y 1 rebanada de queso. Si tienes 10 rebanadas de pan y 6 rebanadas de queso, ¿cuántos sándwiches puedes hacer? Aunque parece que tienes una cantidad suficiente de ambos ingredientes, la cantidad de sándwiches que puedes hacer no está determinada por la cantidad de pan, sino por la cantidad de queso, ya que se agotará primero. En este caso, el queso es el reactivo limitante, porque limita el número total de sándwiches que puedes hacer. El pan, por otro lado, sería el reactivo en exceso, ya que te sobrará una vez que se haya usado todo el queso.
Objetivo de aprendizaje
- Determinar el reactivo limitante y el reactivo en exceso en una reacción química.
1. Definición de reactivo limitante
El reactivo limitante en una reacción química es el reactivo que se consume completamente primero, impidiendo que la reacción continúe y determinando la cantidad máxima de producto que se puede formar.
Identificar el reactivo limitante es fundamental para calcular el rendimiento teórico de una reacción, que es la cantidad máxima de producto que se puede obtener si la reacción procede hasta que todo el reactivo limitante se haya consumido.
2. Definición de reactivo en exceso
El reactivo en exceso es aquel que no se consume completamente en la reacción y queda sobrante una vez que el reactivo limitante se ha agotado. Aunque el reactivo en exceso no limita la cantidad de producto que se puede formar, es importante calcular cuánto queda de este después de que la reacción ha terminado, ya que puede ser relevante en procesos industriales donde se busca optimizar el uso de materiales.
Ejemplo 1. Cálculo del reactivo limitante y reactivo en exceso
En el siguiente ejercicio se muestra cómo identificar el reactivo limitante y el reactivo en exceso. Además, calcularemos la cantidad de reactivo en exceso y la cantidad de producto formado en una reacción química.
Imaginemos la siguiente reacción química:
2H2 + O2 → 2H2O
Supongamos que tienes 5 moles de H2 y 2 moles de O2. Para determinar cuál es el reactivo limitante, debemos calcular cuántos moles de H2 y O2 son necesarios para reaccionar completamente.
- Primero, usemos la estequiometría de la reacción: Se necesitan 2 moles de H2 por cada 1 mol de O2.
- Calculamos la cantidad de H2 necesaria para reaccionar con los 2 moles de O2:
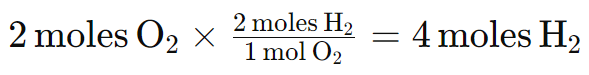
- Comparamos la cantidad de H2 necesaria con la cantidad disponible:
- Tenemos 5 moles de H2, pero solo necesitamos 4 moles para reaccionar con los 2 moles de O2.
- Dado que tenemos más H2 del necesario, el H2 es el reactivo en exceso y el O2 es el reactivo limitante.
- Para calcular la cantidad de H2 que queda sin reaccionar:
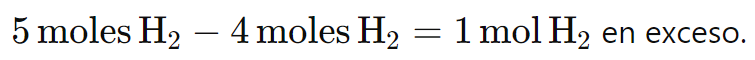
Por lo tanto, al final de la reacción, quedará 1 mol de H2 sin reaccionar, y se formarán 4 moles de H2O.
Ejercicios de práctica
1. Uno de los pasos en el proceso comercial para convertir amoníaco en ácido nítrico es la conversión de NH₃ a NO:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
En un cierto experimento, 2,00 g de NH₃ reaccionan con 2,50 g de O₂.
(a) ¿Cuál es el reactivo limitante?
(b) ¿Cuántos gramos de NO y H₂O se forman?
(c) ¿Cuántos gramos del reactivo en exceso permanecerán después de que el reactivo limitante se ha consumido completamente?
(d) Demuestra que tus cálculos en las partes (b) y (c) son consistentes con la ley de conservación de la masa.
2. La efervescencia que se produce cuando una tableta de Alka-Seltzer se disuelve en agua se debe a la reacción entre el bicarbonato de sodio (NaHCO₃) y el ácido cítrico (H₃C₆H₅O₇):
3NaHCO3(ac) + H3C6H5O7(ac) → 3CO2(g) + 3H2O(l) + Na3C6H5O7(ac)
En un cierto experimento, 1,00 g de bicarbonato de sodio y 1,00 g de ácido cítrico reaccionan.
(a) ¿Cuál es el reactivo limitante?
(b) ¿Cuántos gramos de dióxido de carbono se forman?
(c) ¿Cuántos gramos del reactivo en exceso permanecen después de que el reactivo limitante se haya consumido completamente?
