1. Estequiometría masa a masa
En estos cálculos, los reactivos y productos se expresan en masa. Se plantean preguntas como:
Dada una cantidad X de reactivo, ¿cuánto producto se formará?
Puedes llevar la ecuación N2 + 3H2 → 2NH3 un paso más allá para calcular los gramos de NH3 producidos, utilizando la cantidad en gramos de 1 mol de NH3 (que se encuentra en la tabla periódica):
Gramos en 1 mol de NH3: 14.01 g de N + 3 (1.008 g de H) = 17.03 g
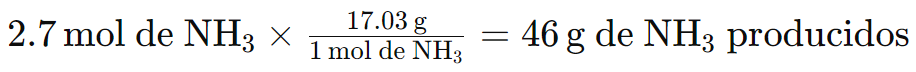
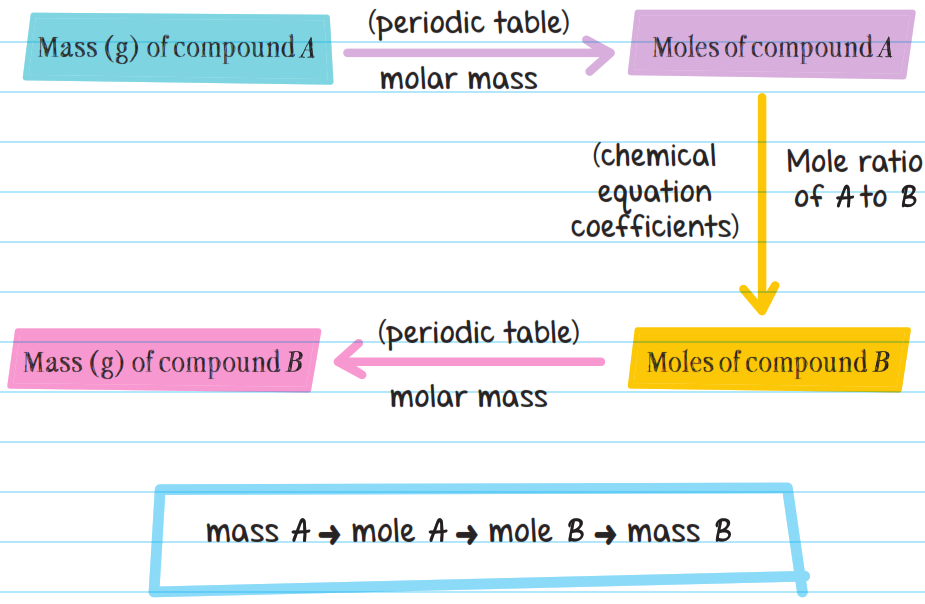
Para resolver problemas de estequiometría masa a masa:
- Escribe una ecuación balanceada para la reacción química.
- Comienza con la masa del reactivo dada en el problema. Convierte la cantidad de reactivo en número de moles.
Masa del Reactivo → Moles del Reactivo - Usa la relación molar de la ecuación balanceada para convertir a moles de producto creado.
Moles del Reactivo → Moles del Producto - Convierte los moles del producto en gramos de producto.
Moles del Producto → Masa del Producto
No es necesario calcular cada sección del problema por separado; en su lugar, se calcula todo el problema en conjunto.
Ejemplo 1: El butano, un hidrocarburo C4H10, sufre combustión para producir dióxido de carbono y agua. Con 236.5 g de butano, ¿cuántos gramos de dióxido de carbono se forman en la reacción?
1. Escribe una ecuación balanceada:
Esta reacción de combustión involucra un hidrocarburo, lo que significa que el oxígeno O2 es un reactivo y el dióxido de carbono CO2 y el agua H2O son los productos.
C4H10 + O2 → CO2 + H2O
La ecuación balanceada es:
2C4H10 + 13O2 → 8CO2 + 10H2O
2. Convierte la cantidad de butano a moles.
Calcula la masa molar del butano.
Masa molar del C4H10 = 4 (12.01 g) C + 10 (1.008 g) H = 58.12 g
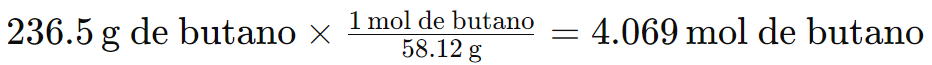
3. Utiliza la cantidad de moles para calcular los moles de CO2.
Obtén la relación molar de la ecuación 2 mol de butano = 8 mol de dióxido de carbono:
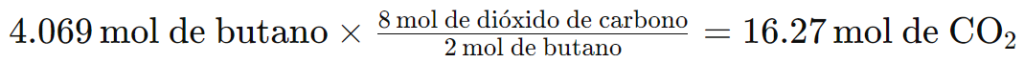
4. Convierte moles a gramos de producto.
Calcula la masa molar del dióxido de carbono.
Masa molar del CO2 = 1(12.01 g) C + 2 (15.999 g) O = 44.01 g
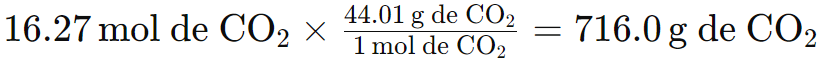
Por lo tanto, 716.0 g de CO2 se producen a partir de 236.5 g de butano.
Ejemplo 2: El sulfuro de hidrógeno gaseoso se quema en oxígeno para producir dióxido de azufre y agua. Con 56.2 g de oxígeno para esta reacción de combustión, ¿cuántos gramos de agua producirá la reacción?
Ecuación balanceada:
2H2S + 3O2 → 2SO2 + 2H2O
Información conocida:
- Hay 56.2 g de O2 (información dada)
- O2 = 32.00 g/mol (de la tabla periódica)
- H2O = 18.02 g/mol (de la tabla periódica)
Factor de conversión:
g O2 → mol O2 → mol H2O → g H2O
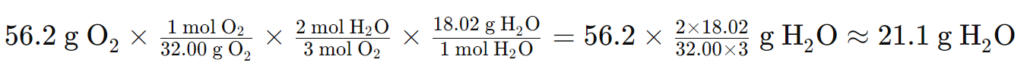
Ejercicios de práctica
1. El sodio reacciona con oxígeno para producir óxido de sodio.
4Na(s) + O₂(g) → 2Na₂O(s)
a) ¿Cuántos gramos de Na₂O se producen cuando reaccionan 57.5 g de Na?
b) Si tienes 18.0 g de Na, ¿cuántos gramos de O₂ se requieren para la reacción?
c) ¿Cuántos gramos de O₂ se necesitan en una reacción que produce 75.0 g de Na₂O?
2. El amoníaco y el oxígeno reaccionan para formar nitrógeno y agua.
4NH₃(g) + 3O₂(g) → 2N₂(g) + 6H₂O(g)
a) ¿Cuántos gramos de O₂ se necesitan para reaccionar con 13.6 g de NH₃?
b) ¿Cuántos gramos de N₂ se pueden producir cuando reaccionan 6.50 g de O₂?
c) ¿Cuántos gramos de H₂O se forman a partir de la reacción de 34.0 g de NH₃?
3. El dióxido de nitrógeno y el agua reaccionan para producir ácido nítrico, HNO₃, y óxido de nitrógeno.
3NO₂(g) + H₂O(l) → 2HNO₃(aq) + NO(g)
a) ¿Cuántos gramos de H₂O se requieren para reaccionar con 28.0 g de NO₂?
b) ¿Cuántos gramos de NO se producen a partir de 15.8 g de H₂O?
c) ¿Cuántos gramos de HNO₃ se producen a partir de 8.25 g de NO₂?
4. Cuando el sulfuro de plomo(II) sólido reacciona con gas oxígeno, los productos son óxido de plomo(II) sólido y gas dióxido de azufre.
a) Escribe la ecuación química balanceada para la reacción.
b) ¿Cuántos gramos de oxígeno se requieren para reaccionar con 29.9 g de sulfuro de plomo(II)?
c) ¿Cuántos gramos de dióxido de azufre se pueden producir cuando reaccionan 65.0 g de sulfuro de plomo(II)?
d) ¿Cuántos gramos de sulfuro de plomo(II) se utilizan para producir 128 g de óxido de plomo(II)?
