El concepto de rendimiento en una reacción es fundamental en la química, especialmente en la industria, donde es crucial optimizar las reacciones para maximizar la producción y minimizar los desperdicios. En esta lección, aprenderemos cómo calcular el rendimiento de una reacción y exploraremos cómo factores como el reactivo limitante y la pureza de los reactivos influyen en este cálculo.
Objetivo de aprendizaje
- Calcular el rendimiento de una reacción considerando factores como el reactivo limitante y la pureza de los reactivos.
1. Rendimiento de una reacción
El rendimiento de una reacción química se refiere a la eficiencia con la que se convierte el reactivo en producto.
Se expresa generalmente como un porcentaje y se calcula comparando la cantidad real de producto obtenido en una reacción con la cantidad teórica de producto que se podría haber obtenido si la reacción hubiera sido completa y sin pérdidas.
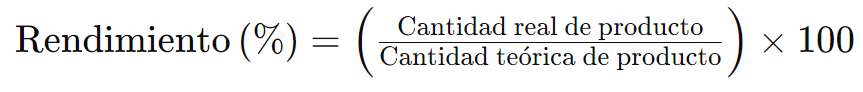
- Cantidad teórica de producto: Es la cantidad máxima de producto que podría formarse a partir de una cantidad dada de reactivos, calculada usando la estequiometría de la reacción.
- Cantidad real de producto: Es la cantidad de producto que se obtiene realmente al final de la reacción.
2. Factores que afectan el rendimiento de una reacción:
- Reactivo limitante: Es el reactivo que se consume por completo y que limita la cantidad de producto que se puede formar.
- Pureza de los reactivos: Si los reactivos no son puros, la cantidad de sustancia pura disponible para reaccionar es menor, lo que afecta el rendimiento.
- Condiciones experimentales: Factores como la temperatura, la presión y la presencia de catalizadores también pueden influir en el rendimiento de la reacción.
Ejemplo 1:
Supongamos que en una reacción química se esperaban obtener 10,0 g de producto (cantidad teórica), pero en realidad solo se obtuvieron 8,0 g (cantidad real). El rendimiento se calcularía de la siguiente manera:
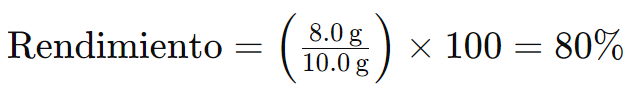
Esto significa que el rendimiento de la reacción es del 80%, es decir, se obtuvo el 80% del producto que se podría haber formado teóricamente.
Ejemplo 2:
Consideremos una reacción donde 5,0 g de un reactivo con una pureza del 90% se usaron para producir 3,5 g de producto. La cantidad teórica de producto que podría formarse a partir de la sustancia pura sería:
Primero, calculamos la masa de reactivo puro:
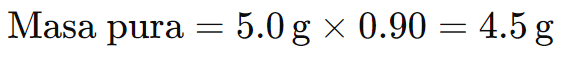
Luego, calculamos la cantidad teórica de producto basado en la estequiometría (suponiendo que toda la masa pura se convierte en producto).
Si la cantidad teórica es 4,0 g, entonces el rendimiento sería:
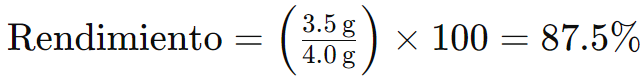
Ejemplo 3:

Ejercicios de práctica
1. Dados 2,0 g de H2 y 8,0 g de O2 que reaccionan para formar agua H2O, calcula el rendimiento de la reacción si se obtienen 9,0 g de agua.
Nota: recuerda determinar primero el reactivo limitante y sobre este, hacer los cálculos de rendimiento.
2. Cuando el benceno (C₆H₆) reacciona con bromo (Br₂), se obtiene bromobenceno (C₆H₅Br):
C6H6 + Br2 → C6H5Br + HBr
(a) Cuando 30,0 g de benceno reaccionan con 65,0 g de bromo, ¿cuál es el rendimiento teórico de bromobenceno?
(b) Si el rendimiento real de bromobenceno es 42,3 g, ¿cuál es el rendimiento porcentual?
3. El sulfuro de hidrógeno es una impureza en el gas natural que debe ser removida. Un método común de eliminación es el proceso Claus, que se basa en la reacción:
8H2S(g) + 4O2(g) → S8(l) + 8H2O(g)
En condiciones óptimas, el proceso Claus da un rendimiento del 98% de S8 a partir de H2S. Si comenzaste con 30,0 g de H2S y 50,0 g de O2, ¿cuántos gramos de azufre S8 se producirían, asumiendo un rendimiento del 98%?
