Las reacciones químicas son procesos fundamentales que transforman unas sustancias en otras. Conocer los diferentes tipos de reacciones químicas nos permite comprender mejor cómo interactúan los elementos y compuestos para formar nuevas sustancias. En esta lección, aprenderemos a identificar y clasificar las reacciones químicas en sus diferentes tipos y estudiaremos ejemplos representativos de cada tipo.
Objetivo de aprendizaje
- Identificar y clasificar los diferentes tipos de reacciones químicas.
1. Reacciones de síntesis (combinación)
En las reacciones de síntesis, dos o más sustancias simples se combinan para formar una sustancia más compleja. Este tipo de reacción se puede representar de la siguiente manera:
Ejemplo:
2H2(g) + O2(g) → 2H2O(l)
En esta reacción, el hidrógeno y el oxígeno se combinan para formar agua.
2. Reacciones de descomposición
En las reacciones de descomposición, una sustancia compleja se descompone en dos o más sustancias más simples. La representación general es:

Ejemplo:
2H2O2(l) → 2H2O(l) + O2(g)
En esta reacción, el peróxido de hidrógeno se descompone en agua y oxígeno.
3. Reacciones de desplazamiento simple (sustitución simple)
En las reacciones de desplazamiento simple, un elemento reactivo reemplaza a otro elemento en un compuesto. La ecuación general es:

Ejemplo:
Zn(s) + 2HCl(ac) → ZnCl2(ac) + H2(g)
En esta reacción, el zinc desplaza al hidrógeno en el ácido clorhídrico para formar cloruro de zinc e hidrógeno gaseoso.
4. Reacciones de desplazamiento doble (sustitución doble)
En las reacciones de desplazamiento doble, los iones de dos compuestos intercambian lugares para formar dos nuevos compuestos. La ecuación general es:

Ejemplo:
AgNO3(ac) + NaCl(ac) → AgCl(s) + NaNO3(ac)
En esta reacción, los iones de nitrato de plata y cloruro de sodio intercambian lugares para formar cloruro de plata sólido y nitrato de sodio en solución.
5. Reacciones de combustión
En las reacciones de combustión, una sustancia reacciona rápidamente con oxígeno, liberando energía en forma de luz y calor. La ecuación general para la combustión completa de un hidrocarburo es:
CxHy + O2 → CO2 + H2O
Ejemplo:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
En esta reacción, el metano reacciona con oxígeno para producir dióxido de carbono y agua.
Entender los diferentes tipos de reacciones químicas es crucial para la comprensión de cómo se transforman las sustancias en química. Cada tipo de reacción tiene características distintivas y patrones específicos que nos permiten predecir los productos de las reacciones químicas. Practicar la identificación y clasificación de estos tipos de reacciones nos ayudará a profundizar en el estudio de la química y sus aplicaciones prácticas.

Ejercicios de práctica
1. Clasifique cada una de las siguientes reacciones como combinación, descomposición, sustitución simple, sustitución doble o reacción de combustión:
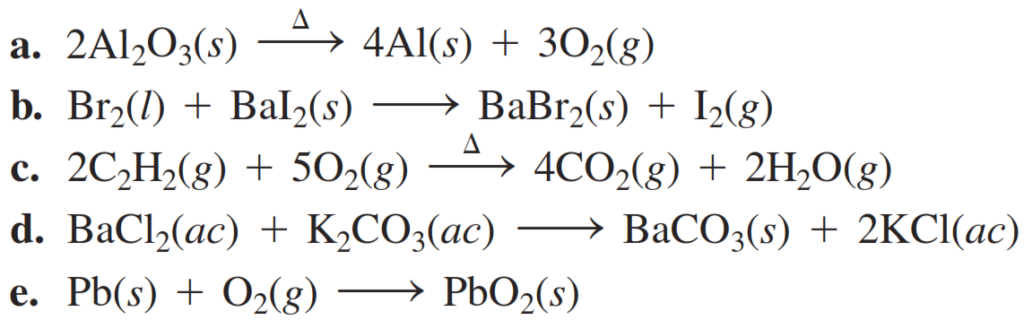
2. Prediga los productos que resultarían de cada una de las siguientes reacciones. Utilice la tabla “Resumen de los Tipos de Reacciones Químicas”:

Laboratorio: Tipos de reacciones químicas
Objetivo:
- Identificar los tipos de reacciones químicas observadas en el laboratorio.
Materiales:
| Sustancias | Materiales | Equipos |
|---|---|---|
| Zinc metálico (Zn) | Tubos de ensayo | Mechero de alcohol |
| Ácido clorhídrico (HCl) | Pinzas para tubos | Gradilla para tubos de ensayo |
| Peróxido de hidrógeno (H2O2) | Espátula | Probeta |
| Yoduro de potasio (KI) | Vaso de precipitados | Soporte universal |
| Nitrato de plata (AgNO3) | Varilla de vidrio | Pinzas para crisol |
| Sulfato de cobre (CuSO4) | Papel filtro | Balanza |
| Ácido sulfúrico (H2SO4) | Embudo | Cronómetro |
| Hidróxido de sodio (NaOH) | Mortero y mano | Termómetro |
Procedimiento:
- Reacción de síntesis:
- Colocar una pequeña cantidad de zinc metálico en un tubo de ensayo.
- Añadir unas gotas de ácido clorhídrico (HCl) y observar la reacción.
- Registrar las observaciones.
- Reacción de descomposición:
- Llenar un vaso de precipitados con 50 ml de peróxido de hidrógeno (H2O2).
- Añadir una pizca de yoduro de potasio (KI) y observar la reacción.
- Registrar las observaciones.
- Reacción de Desplazamiento Simple:
- Colocar una tira de zinc metálico en una solución de sulfato de cobre (CuSO4) en un tubo de ensayo.
- Observar y registrar cualquier cambio que ocurra.
- Reacción de Desplazamiento Doble:
- Mezclar 10 ml de nitrato de plata (AgNO3) con 10 ml de cloruro de sodio (NaCl) en un vaso de precipitados.
- Observar la formación de precipitado y registrar las observaciones.
- Reacción de Combustión:
- En el mecher Bunsen, colocar una pequeña muestra de magnesio (Mg) con pinzas y encenderlo.
- Observar la reacción y registrar las observaciones.
Tabla de resultados:
| Tipo de Reacción | Observaciones |
|---|---|
| Síntesis | ——————————————————- |
| Descomposición | ——————————————————- |
| Desplazamiento Simple | ——————————————————- |
| Desplazamiento Doble | ——————————————————- |
| Combustión | ——————————————————- |
Discusión de resultados
- ¿Qué indicios observaste que confirmaron la presencia de una reacción química en cada experimento?
- En la reacción de síntesis, ¿qué se formó como producto?
- En la reacción de descomposición, ¿qué gas se liberó?
- En la reacción de desplazamiento simple, ¿qué cambios observaste en el zinc y en la solución de sulfato de cobre?
- En la reacción de desplazamiento doble, ¿cómo supiste que se formó un precipitado?
- ¿Cómo diferenciarías la reacción de combustión de las otras reacciones observadas?
Conclusiones
- ¿Qué tipo de reacción química es la formación de agua a partir de hidrógeno y oxígeno?
- ¿Por qué es importante balancear las ecuaciones químicas?
- ¿Qué aprendiste sobre la conservación de la masa en las reacciones químicas observadas?
- ¿Cómo afectan las condiciones experimentales (como la temperatura y la concentración) a la velocidad de las reacciones químicas observadas?
- ¿Cuál de las reacciones observadas crees que tiene mayor aplicación práctica en la vida cotidiana y por qué?
