La fracción molar es una forma precisa de expresar la concentración en soluciones y se utiliza con frecuencia en química, especialmente en el estudio de propiedades coligativas. A diferencia de otras concentraciones, la fracción molar no depende de la temperatura y es útil para analizar soluciones donde tanto el soluto como el disolvente pueden estar presentes en diferentes cantidades.
En esta clase, aprenderemos a calcular la fracción molar y a interpretar su significado en distintos contextos químicos.
Objetivo de aprendizaje
Calcular la fracción molar de una solución y aplicar este conocimiento en situaciones experimentales y teóricas de química.
1. Definición de fracción molar (X)
La fracción molar es una medida de concentración que representa la relación entre el número de moles de un componente (soluto o disolvente) y el número total de moles en la solución. Se expresa como un número entre 0 y 1 y no tiene unidades, ya que es una razón.
La fórmula para la fracción molar de un componente A es:
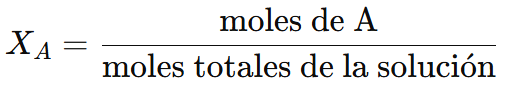
Donde:
- Moles de A: Número de moles del componente que estamos analizando (puede ser el soluto o el disolvente).
- Moles totales de la solución: Suma de los moles de todos los componentes presentes en la solución.
2. Propiedades de la fracción molar
- La fracción molar es adimensional y siempre es un valor entre 0 y 1.
- La suma de las fracciones molares de todos los componentes en una solución siempre es igual a 1.
- No depende de la temperatura, lo que la hace útil en estudios que implican cambios térmicos.
3. Aplicación de la fracción molar
- La fracción molar es fundamental para calcular propiedades coligativas como la presión de vapor, el punto de ebullición y el punto de congelación.
- Es utilizada en mezclas líquidas y gaseosas, y resulta útil en situaciones donde las masas y los volúmenes no son tan importantes como las cantidades relativas de cada componente.
4. Ejemplos resueltos
Ejemplo 1: Se prepara una solución mezclando 2 moles de etanol (C₂H₆O) y 8 moles de agua (H₂O). Calcular la fracción molar de cada componente.
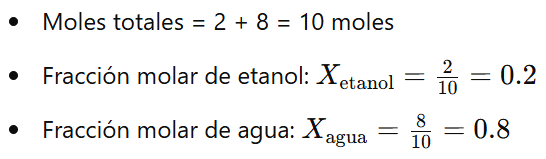
Respuesta: La fracción molar de etanol es 0.2 y la de agua es 0.8.
Ejemplo 2: En una solución se mezclan 0.5 moles de NaCl con 2 moles de agua. Calcular la fracción molar de NaCl y de agua.
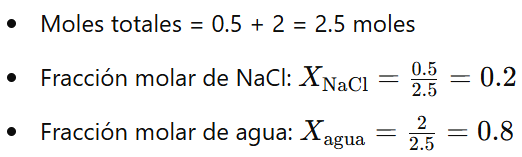
Respuesta: La fracción molar de NaCl es 0.2 y la de agua es 0.8.
Ejercicios de práctica
- Se disuelven 92 gramos de sacarosa (C12H22O11) en 500 gramos de agua (H2O). Calcula la fracción molar de la sacarosa en la solución.
- Se prepara una solución añadiendo 0.5 moles de cloruro de sodio (NaCl) a suficiente agua para hacer un total de 1.2 moles de solución. ¿Cuántos moles de agua (H2O) se utilizaron?
