La molalidad es otra medida de concentración importante en química. A diferencia de la molaridad, la molalidad se basa en la cantidad de moles de soluto por kilogramo de disolvente, lo que la hace especialmente útil en estudios que involucran cambios de temperatura, ya que no depende del volumen de la solución.
En esta clase, exploraremos qué es la molalidad, cómo se calcula y en qué situaciones resulta ventajosa.
Objetivo de aprendizaje
Calcular la molalidad de una solución y aplicar este conocimiento en problemas y experimentos de química.
1. Definición de molalidad (m)
La molalidad (m) es una medida de la concentración de una solución, expresada como el número de moles de soluto por kilogramo de disolvente. La fórmula para calcular la molalidad es:

Donde:
- Moles de soluto: La cantidad de sustancia que se disuelve en el disolvente.
- Kilogramos de disolvente: La masa del disolvente en el que se disuelve el soluto, expresada en kilogramos.
2. Importancia de la molalidad
- Independencia de la temperatura: La molalidad no depende de cambios de volumen con la temperatura, lo que la hace ideal para estudios termodinámicos.
- Aplicaciones en propiedades coligativas: Es fundamental para calcular propiedades como el descenso del punto de congelación y el aumento del punto de ebullición.
- Exactitud en reacciones: La molalidad permite una mayor precisión en experimentos donde la temperatura puede variar.
3. Ejemplos Resueltos
Ejemplo 1: Calcular la molalidad de una solución que contiene 3 moles de NaCl disueltos en 2 kg de agua.
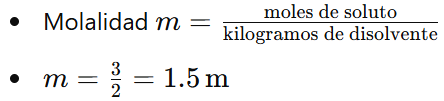
Respuesta: La molalidad de la solución es 1.5 m.
Ejemplo 2: Calcular la molalidad de una solución que contiene 20 gramos de KCl disueltos en 500 gramos de agua.

Respuesta: La molalidad de la solución es aproximadamente 0.536 m.
Ejercicios de práctica
- ¿Cuál es la molalidad de una solución que se prepara disolviendo 29.2 gramos de cloruro de sodio (NaCl) en 500 gramos de agua? La masa molar del NaCl es de aproximadamente 58.44 g/mol.
- Si se desea preparar una solución 0.8 molal de glucosa (C6H12O6) disolviendo 18 g de glucosa, ¿cuántos gramos de agua se necesitan? La masa molar de la glucosa es de 180 g/mol.
- Se disuelven 500 gramos de solvente para formar una solución 2 molal. Si la masa molar del soluto es de 34 g/mol, ¿cuál es la masa del soluto?
