La molaridad es una medida clave en química que se utiliza para expresar la concentración de soluciones. Esta unidad se basa en la cantidad de moles de soluto disueltos en un litro de solución, lo cual es especialmente útil en experimentos de laboratorio y en cálculos de reacciones químicas.
En esta clase, aprenderemos cómo calcular la molaridad, su importancia en la química y cómo aplicarla en situaciones prácticas.
Objetivo de aprendizaje
Calcular la molaridad de una solución y aplicar este conocimiento en problemas y experimentos de química.
1. Definición de molaridad (M)
La molaridad (M) es una medida de la concentración de una solución, expresada como el número de moles de soluto por litro de solución. Se define mediante la fórmula:

Donde:
- Moles de soluto: Es la cantidad de sustancia que se disuelve en el disolvente.
- Litros de solución: Es el volumen total de la solución (no solo del disolvente).
2. Importancia de la molaridad
- En reacciones químicas: La molaridad es fundamental para calcular la cantidad exacta de reactivos y productos en una reacción química.
- Preparación de soluciones: Ayuda a preparar soluciones específicas en el laboratorio y es una de las concentraciones más usadas.
- Facilidad de cálculo: Permite realizar cálculos estequiométricos fácilmente, especialmente en reacciones en soluciones acuosas.
3. Ejemplos resueltos
Ejemplo 1: Calcular la molaridad de una solución que contiene 5 moles de NaCl en 2 litros de solución.
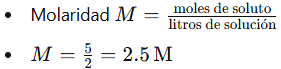
Respuesta: La molaridad de la solución es 2.5 M.
Ejemplo 2: Calcular la molaridad de una solución que contiene 20 gramos de KCl en 500 mL de solución.

Respuesta: La molaridad de la solución es aproximadamente 0.536 M.
Ejemplo 3: Se disuelven 10 gramos de NaOH en agua hasta obtener 250 mL de solución. Calcular la molaridad de la solución.
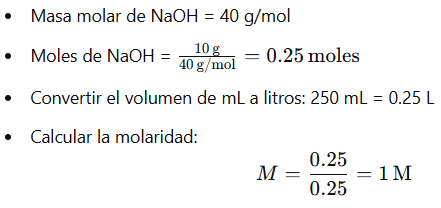
Respuesta: La molaridad de la solución es 1 M.
Ejercicios propuestos
- Calcular la molaridad de una solución que contiene 3 moles de H₂SO₄ en 1.5 litros de solución.
- Una solución contiene 12 gramos de NaCl en 1 litro de solución. Calcular su molaridad.
- Se preparan 100 mL de una solución disolviendo 8 gramos de KNO₃. Calcular la molaridad de la solución.
- ¿Cuántos litros de agua son necesarios para diluir 100 mililitros de una solución 6.0 M de HCl para obtener una solución 1.5 M?
- ¿Cuánta glucosa (C6H12O6) se necesita para preparar 2.0 L de una solución 0.5 M?
