La normalidad es una medida de concentración que se usa ampliamente en reacciones químicas, especialmente en reacciones ácido-base y de oxidación-reducción. La normalidad permite expresar la cantidad de equivalentes de un soluto presentes en un litro de solución, lo que facilita cálculos precisos en reacciones donde se requiere tener en cuenta los iones o electrones involucrados.
En esta clase, aprenderemos cómo calcular la normalidad y en qué situaciones es más útil aplicarla.
Objetivo de aprendizaje
Calcular la normalidad de una solución y aplicar este concepto en problemas y experimentos de química.
1. Definición de normalidad (N)
La normalidad (N) es una medida de la concentración de una solución, expresada como el número de equivalentes de soluto por litro de solución. La fórmula para calcular la normalidad es:

Donde:
- Equivalentes de soluto: Es la cantidad de soluto en términos de sus equivalentes químicos. Depende del tipo de reacción:
- Para ácidos y bases, el equivalente es la cantidad de sustancia que dona o acepta un mol de protones, H+.
- Para reacciones de oxidación-reducción, el equivalente es la cantidad de sustancia que dona o acepta un mol de electrones.
- Para ácidos y bases, el equivalente es la cantidad de sustancia que dona o acepta un mol de protones, H+.
- Litros de solución: Es el volumen total de la solución en litros.
2. Cálculo del número de equivalentes
Los equivalentes se calculan en función de la valencia o factor de equivalencia del compuesto, dependiendo del contexto:
- Para ácidos: El equivalente se basa en el número de protones H+ que el ácido puede donar. Ejemplo: H₂SO₄ tiene 2 equivalentes por mol porque puede donar 2 protones.
- Para bases: El equivalente se basa en el número de iones OH− que puede aceptar. Ejemplo: Ca(OH)₂ tiene 2 equivalentes por mol.
- Para sales: Depende de la carga del ion que se forma.
- Para reacciones redox: El equivalente depende de los electrones ganados o perdidos.
La relación entre moles y equivalentes es:
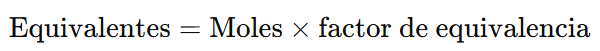
3. Aplicaciones de la normalidad
- Titulaciones ácido-base: La normalidad es útil en reacciones de neutralización, ya que facilita el cálculo de la cantidad exacta de ácido o base necesario.
- Reacciones de precipitación y redox: En reacciones de oxidación-reducción, la normalidad permite tener en cuenta el número de electrones transferidos.
- Análisis industrial y laboratorio: La normalidad se emplea en análisis donde la precisión en el intercambio de iones es clave.
4. Ejemplos resueltos de cómo calcular la normalidad
Ejercicio 1: Cálculo de la normalidad dado el peso y volumen

Ejercicio 2: Cálculo del volumen necesario para una normalidad deseada

