La concentración de una solución puede expresarse de muchas formas, y una de las más comunes y útiles en la vida cotidiana es el porcentaje en masa. Este concepto nos permite entender qué proporción de una mezcla está compuesta por el soluto, ya sea en productos de limpieza, alimentos, o incluso en el análisis de soluciones químicas.
Hoy, vamos a explorar cómo calcular el porcentaje en masa de una solución y cómo aplicar este conocimiento en situaciones prácticas.
Objetivo de aprendizaje
Calcular el porcentaje en masa de una solución y aplicarlo en problemas prácticos de la vida real y del laboratorio.
1. Porcentaje en masa (% m/m)
El porcentaje en masa (% m/m) de una solución indica la proporción de soluto en relación con la masa total de la solución, expresada como un porcentaje. La fórmula para calcular el porcentaje en masa es:
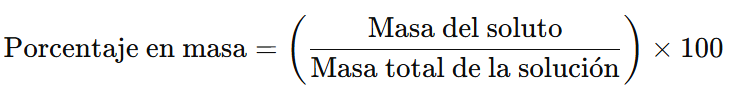
Donde:
- Masa del soluto: Cantidad de la sustancia disuelta en la solución.
- Masa total de la solución: Suma de la masa del soluto y la masa del disolvente.
2. Importancia del porcentaje en masa
- Control de calidad: En alimentos, cosméticos y productos químicos, el porcentaje en masa ayuda a regular y asegurar que los productos cumplan con normas específicas.
- Uso en el laboratorio: Conocer el porcentaje en masa permite ajustar la concentración de una solución de forma precisa en experimentos.
- Ejemplos cotidianos: El vinagre (5% de ácido acético) y las soluciones de agua oxigenada (3% o 6% de peróxido de hidrógeno) suelen indicar concentraciones en porcentaje en masa.
Ejercicios de práctica
- Se preparó una solución disolviendo 10.0 g de ácido acético (CH3COOH) en 90.0 g de agua. ¿Cuál es el porcentaje masa/masa de ácido acético en la solución?
- Si se prepara una solución de glucosa (C6H12O6) en agua, y el porcentaje masa/masa de la solución es 15.0%, ¿cuál es la masa de glucosa disuelta en 250.0 g de solución?
- Se disuelven 5.0 g de cloruro de potasio (KCl) en una cantidad desconocida de agua para formar una solución con un porcentaje masa/masa de 4.0%. ¿Cuál es la masa total de la solución? ¿Cuál es la masa de agua que se requirió?
