La densidad y la masa molar son propiedades esenciales para entender el comportamiento de los gases y para realizar cálculos en química y física. La densidad de un gas nos indica cuánta masa hay en un volumen determinado, mientras que la masa molar nos ayuda a conocer la cantidad de sustancia en moles que equivale a una masa específica.
Estos conceptos son fundamentales en estudios de gases, y nos permiten relacionar sus propiedades y calcular su cantidad en distintas condiciones. En esta clase, exploraremos cómo calcular la densidad y la masa molar de un gas y su aplicación en problemas prácticos.
Objetivo de aprendizaje
Calcular la densidad y la masa molar de un gas usando la ecuación de los gases ideales y comprender su relación en diferentes condiciones.
1. Densidad de un gas
La densidad (ρ) es una medida de la cantidad de masa por unidad de volumen y se expresa en unidades como gramos por litro (g/L) o gramos por metro cúbico (g/m³) para los gases. Para un gas, la densidad depende de su masa molar, presión y temperatura, y se puede calcular mediante la ecuación de los gases ideales combinada con la definición de densidad:
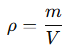

Al combinar la ecuación de los gases ideales (PV=nRT) con el concepto de densidad, se obtiene:
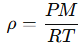
donde:

2. Masa molar de un gas
La masa molar (M) de un gas es la masa en gramos de un mol del gas y se expresa en unidades de g/mol. Para encontrar la masa molar a partir de la densidad, se usa la ecuación derivada de la ecuación de los gases ideales:
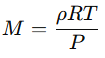
Esto significa que, si conocemos la densidad de un gas y las condiciones de presión y temperatura, podemos calcular su masa molar.
3. Relación entre densidad, masa molar y la ecuación de los gases ideales
La ecuación de los gases ideales y la fórmula de densidad de los gases nos permiten relacionar directamente la densidad y la masa molar. Este tipo de cálculos es útil en aplicaciones como la identificación de gases desconocidos y el estudio de mezclas de gases en química e ingeniería.
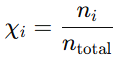
Donde:

Ejercicios de práctica
- Se produce cierta reacción, produciendo un óxido de nitrógeno como gas. El gas tiene una masa de 1.211g y ocupa un volumen de 677mL. La temperatura en el laboratorio es 23 °C y la presión del aire es 0.987atm. Calcular la masa molar del gas y deducir su fórmula. Supongamos que el gas es ideal.
- En un tanque industrial se trabaja con nitrógeno (N2) gaseoso a altas temperaturas (216 °C) y a la presión de 4,5 atm. Determine la densidad del gas en estas condiciones.
