La ecuación de los gases ideales es una fórmula que relaciona cuatro variables fundamentales de un gas (presión, volumen, temperatura y cantidad de sustancia) y permite predecir su comportamiento bajo distintas condiciones. Esta ecuación es una herramienta esencial en química y física y se aplica en contextos diversos, desde la industria hasta estudios atmosféricos. En esta clase, exploraremos qué es la ecuación de los gases ideales, cómo utilizarla y qué limitaciones presenta en situaciones prácticas.
Objetivo de aprendizaje
Aplicar la ecuación de los gases ideales para calcular las variables de un gas en distintas condiciones, utilizando la relación entre presión, volumen, temperatura y cantidad de sustancia.
1. Ecuación de los gases ideales
La ecuación de los gases ideales relaciona la presión, el volumen, la temperatura y la cantidad de sustancia de un gas mediante la fórmula:
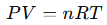
donde:

Esta ecuación es aplicable a gases “ideales,” es decir, aquellos que cumplen ciertas condiciones de idealidad donde las partículas no interactúan entre sí y ocupan un espacio insignificante. En la práctica, se aproxima bastante bien para muchos gases a temperatura y presión normales.
2. Constante de los gases ideales (R)
La constante de los gases ideales, R, es un valor experimental que relaciona las diferentes unidades de presión, volumen y temperatura en la ecuación de los gases ideales. Su valor depende de las unidades utilizadas para presión y volumen:
- 0.0821 L·atm/mol·K si la presión está en atmósferas y el volumen en litros.
- 8.31 J/mol·K si la presión está en pascales y el volumen en metros cúbicos.
3. Aplicaciones de la ecuación de los gases ideales
La ecuación de los gases ideales es útil para resolver problemas donde se conoce la mayoría de las variables (presión, volumen, cantidad de gas o temperatura) y se necesita calcular la variable restante. Es ampliamente utilizada en:
- Cálculos estequiométricos en reacciones de gases.
- Determinación del volumen o presión de gases en condiciones específicas.
- Predicción del comportamiento de gases en condiciones de laboratorio e industria.
4. Masa molar de un gas
La masa molar de un gas es la masa de un mol de moléculas o átomos de ese gas. Es una propiedad importante para entender la cantidad de sustancia presente en una muestra de gas y se utiliza en varias ecuaciones, como la ecuación de los gases ideales.
Cómo calcular la masa molar de un gas:
- Reordenar la ecuación de los gases ideales para despejar n:

5. Condiciones Normales de Temperatura y Presión, CNTP
Las condiciones normales de temperatura y presión (CNTP) son un conjunto estándar de condiciones utilizadas para expresar las propiedades de los gases en un estado específico. Estas condiciones permiten hacer comparaciones y cálculos consistentes en experimentos de química, especialmente cuando se trata de gases ideales.
Estas condiciones se definen como:
- Temperatura: 0°C o 273.15 K
- Presión: 1 atmósfera (atm) o 101.3 kPa
Estas condiciones facilitan el cálculo de volumen, presión y cantidad de gas, ya que los resultados son consistentes a nivel global.
¿Por qué son importantes las CNTP?
Las CNTP se utilizan como referencia en los cálculos de gases ideales, ya que permiten realizar comparaciones entre diferentes experimentos y situaciones. Es especialmente útil en la ley de los gases ideales, la cual describe la relación entre el volumen, la presión, la temperatura y la cantidad de gas. Además, las CNTP son importantes para:
- Convertir condiciones de gases reales a condiciones estándar para comparaciones.
- Establecer volúmenes molares estándar, es decir, el volumen ocupado por un mol de gas bajo CNTP (22.4 L para gases ideales).
6. Limitaciones de la ecuación de los gases ideales
La ecuación de los gases ideales es una aproximación. No funciona con precisión en situaciones donde las partículas del gas interactúan entre sí, como:
- Bajas temperaturas: Donde las fuerzas de atracción entre partículas se vuelven significativas.
- Altas presiones: Donde el volumen de las partículas ya no es insignificante.
Para estos casos, se utiliza la ecuación de Van der Waals, que ajusta la ecuación de los gases ideales tomando en cuenta las interacciones entre partículas y el volumen propio de las moléculas.
Ejercicios de práctica
- El óxido de dinitrógeno, N2O, que se utiliza en odontología, es un anestésico llamado gas de la risa. ¿Cuál es la presión, en atmósferas, de 0.350 moles de gas N2O a 22°C en un recipiente de 5.00 L?
- El gas isobutano, C4H10, se utiliza como propulsor en los envases de aerosol de crema batida, crema de afeitar y spray para bronceado. ¿Cuál es la presión, en atmósferas, de 0.125 moles de isobutano en un envase de aerosol a 21°C con un volumen de 465 mL?
- ¿Cuál es la masa molar, en gramos por mol, de un gas desconocido en un recipiente de 1.50 L, si 0.488 g del gas tiene una presión de 0.0750 atm a 19°C?
- Determine la masa molar de 2.90 g de un gas que ocupa 0.500 L a 0 °C y 1.00 atm (CNTP).
