En el contexto de la estequiometría masa-volumen, se trata de calcular la cantidad de sustancia en términos de masa o volumen, dependiendo de si estamos trabajando con sólidos, líquidos o gases. Esta rama es crucial para realizar cálculos precisos sobre las cantidades de reactivos y productos en una reacción, especialmente cuando tratamos con reacciones que involucran gases.
Objetivo de aprendizaje
Comprender y aplicar los conceptos de la estequiometría masa-volumen para realizar cálculos en reacciones químicas.
1. Estequiometría masa-volumen
A veces, los reactivos o productos gaseosos se miden en volumen en lugar de en masa.
Temperatura y presión estándar (en inglés, STP; en español, CNTP):
- Temperatura: 0 °C o 273,15 Kelvin (K)
- Presión: 1 atmósfera (atm)
En CNTP, este factor de conversión es válido para los gases:
- 1 mol de cualquier gas = 22,4 L (L = litro)

o también
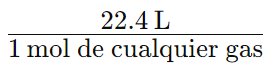
El volumen molar de un gas en CNTP es igual a 22,4 L para 1 mol de cualquier gas ideal a una temperatura de 273,15 K y una presión de 1,00 atm. Un gas ideal es un gas teórico que cumple consistentemente con las leyes de los gases.
Para resolver problemas de estequiometría masa – volumen:
- Escribe una ecuación química balanceada para la reacción.
- Convierte la cantidad de reactivo a número de moles.
- Usa la relación molar de la ecuación balanceada para convertir la cantidad (en moles) del producto formado.
- Convierte los moles del producto a litros del producto usando el factor de conversión CNTP para gases.
Ejemplo 1: El magnesio reacciona con el ácido clorhídrico, produciendo gas y cloruro de magnesio. ¿Cuál es el volumen de gas a CNTP producido en esta reacción cuando se tienen 54,6 g de HCl y Mg en abundancia?
Escribe la ecuación balanceada:
Ecuación inicial: Mg(s) + HCl → MgCl2 + H2(g)
Ecuación balanceada: Mg(s) + 2HCl → MgCl2 + H2(g)
Masa molar del HCl:
HCl = 1(1,008 g)H + 1(35,45 g)Cl = 36,46 g
Volumen de H2 generado:
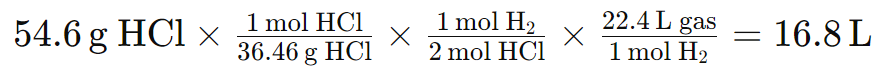
Ejemplo 2: Conversión de volumen a masa
12,3 L de H2 gaseoso se crean cuando se añade el zinc al ácido sulfúrico. ¿Cuánto zinc, en masa, se necesita para esta reacción cuando ocurre en CNTP?
Solución:
Datos conocidos:
- 12,3 L de H2 gas
- Masa molar de ácido sulfúrico (H₂SO₄) = 98,08 g/mol
- Masa molar de zinc (Zn) = 65,38 g/mol
- Masa molar de H2 = 2,01 g/mol
- 1 mol de gas a CNTP = 22,4 L/mol
Ecuación balanceada:
Zn(s) + H2SO4 → ZnSO4 + H2(g)
Conversion:
L de H2 → mol H2 → relación molar de H2 a Zn → g Zn
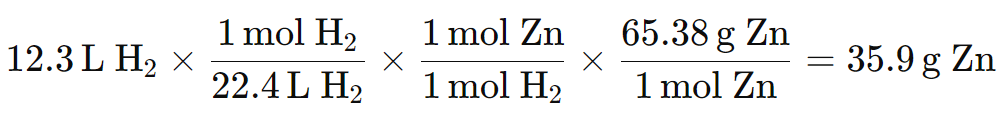
Ejercicio de práctica
- En la siguiente reacción de combustión completa del metano (CH4):
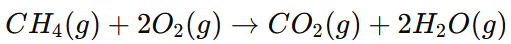
Si tenemos 4.00 moles de metano y un exceso de oxígeno, ¿cuántos litros de dióxido de carbono se producirán a CNTP?
