La Ley de Dalton y el concepto de presiones parciales son fundamentales para entender cómo se comportan las mezclas de gases. En una mezcla de gases, cada gas ejerce su propia presión, y la suma de estas presiones se denomina presión total. Comprender la Ley de Dalton nos permite predecir y calcular las presiones en sistemas de gases, lo que es útil en aplicaciones desde sistemas respiratorios hasta la industria química.
Objetivo de aprendizaje
Aplicar la Ley de Dalton para calcular las presiones parciales de los gases en una mezcla y comprender su comportamiento en diferentes contextos.
1. Ley de Dalton de las presiones parciales
La Ley de Dalton establece que la presión total (Ptotal) de una mezcla de gases es igual a la suma de las presiones parciales de cada gas que compone la mezcla. Una presión parcial es la presión que un gas específico ejercería si estuviera solo en el mismo volumen y a la misma temperatura. Matemáticamente, se expresa como:
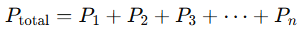
Donde:

2. Presión parcial de un gas
La presión parcial de un gas en una mezcla se puede calcular si conocemos la fracción molar de ese gas en la mezcla y la presión total. La fracción molar (χ) de un gas es el cociente entre el número de moles de ese gas y el número total de moles de la mezcla. La presión parcial de un gas (Pi) es:
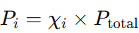
Donde:

3. Fracción Molar
La fracción molar de un gas en una mezcla es la relación entre el número de moles de ese gas y el número total de moles de la mezcla. Se expresa como:
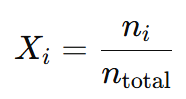

4. Relación entre presiones parciales y fracción molar
La Ley de Dalton nos muestra que la presión parcial de un gas es proporcional a su fracción molar. Esta relación es muy útil porque, conociendo la fracción molar de un gas, podemos calcular su presión parcial en una mezcla.
Por ejemplo, si tenemos una mezcla de dos gases, el gas A y el gas B, la fracción molar de A y B se puede expresar como:
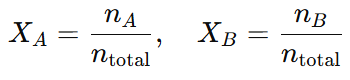
Y las presiones parciales de los gases en la mezcla serán:
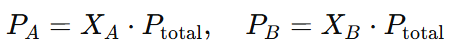
De esta manera, la presión total de la mezcla es la suma de las presiones parciales de cada gas, y cada gas contribuye a la presión total en función de su fracción molar.
Ejercicios de práctica
- Una muestra típica de aire en los pulmones contiene oxígeno a 100 mmHg, nitrógeno a 573 mmHg, dióxido de carbono a 40 mmHg y vapor de agua a 47 mmHg. ¿Por qué se llaman presiones parciales?
- En una mezcla de gases, las presiones parciales son nitrógeno 425 Torr, oxígeno 115 Torr y helio 225 Torr. ¿Cuál es la presión total, en torr, ejercida por la mezcla de gases?
