Los gases se comportan de maneras particulares cuando cambian las condiciones de presión, volumen y temperatura. Estas relaciones fueron estudiadas y formuladas en varias leyes, conocidas como las leyes de los gases. Estas leyes nos permiten predecir y calcular cómo un gas responderá a cambios en su entorno y son esenciales en muchas aplicaciones científicas e industriales.
En esta clase, aprenderemos sobre la Ley de Boyle, la Ley de Charles, la Ley de Gay-Lussac y la Ley Combinada de los Gases.
Objetivo de aprendizaje
Comprender y aplicar las leyes de los gases para predecir cómo cambian la presión, el volumen y la temperatura de un gas bajo diferentes condiciones.
1. Ley de Boyle
La Ley de Boyle establece que, para una cantidad fija de gas a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Esto significa que si la presión aumenta, el volumen disminuye, y viceversa. La fórmula de esta ley es:
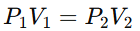
donde:

Aplicación: Esta ley se observa al comprimir un gas en un émbolo, como cuando se presiona el émbolo de una jeringa cerrada y el volumen del gas disminuye.
2. Ley de Charles
La Ley de Charles establece que, para una cantidad fija de gas a presión constante, el volumen de un gas es directamente proporcional a su temperatura (en kelvin). Esto implica que si la temperatura aumenta, el volumen también aumenta. La fórmula de esta ley es:
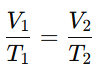
donde:

Aplicación: Esta ley se puede observar al inflar un globo y exponerlo al calor; el globo se expande al aumentar la temperatura del gas en su interior.
3. Ley de Gay-Lussac
La Ley de Gay-Lussac establece que, para una cantidad fija de gas a volumen constante, la presión de un gas es directamente proporcional a su temperatura (en kelvin). Esto significa que al aumentar la temperatura, la presión también aumenta. La fórmula de esta ley es:
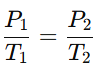
Aplicación: Esta ley se observa en recipientes cerrados, como en una lata de aerosol, donde al aumentar la temperatura, la presión en el interior aumenta, pudiendo llegar a niveles peligrosos.
4. Ley combinada de los gases
La ley combinada de los gases reúne las tres leyes anteriores en una sola expresión, relacionando presión, volumen y temperatura para una cantidad fija de gas. La fórmula es:
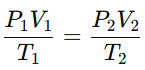
Esta ley es útil cuando cambian simultáneamente la presión, el volumen y la temperatura de un gas, y permite calcular cualquiera de estas variables cuando se conocen las otras.
Aplicación: La Ley Combinada se aplica en situaciones donde el gas experimenta varios cambios a la vez, como en un recipiente de gas expuesto a cambios de temperatura y presión al mismo tiempo.
Ejercicios de práctica
- Una muestra de hidrógeno gaseoso a 1,5 atmósferas tiene su presión disminuida a 0,50 atmósferas, lo que produce un nuevo volumen de 750 mL. ¿Cuál era su volumen inicial?
- El flúor gaseoso ejerce una presión de 900 Torr. Cuando la presión cambia a 1,50 atmósferas, su volumen es de 250 mL. ¿Cuál era el volumen original?
- El helio ocupa un volumen de 3,8 litros a -45°C. ¿Qué volumen ocupará a 45°C?
- Una muestra de gas argón se enfría y su volumen pasa de 380 mL a 250 mL. Si su temperatura final fue de -55°C, ¿cuál era su temperatura inicial en grados Celsius?
- Las bacterias y los virus se inactivan a temperaturas superiores a los 135 °C. Un autoclave contiene vapor a 1,00 atmósfera y 100 °C. ¿Cuál es la presión, en atmósferas, cuando la temperatura del vapor en el autoclave alcanza los 135 °C, si el volumen y la cantidad de gas no cambian?
- Durante la cirugía laparoscópica, se utiliza dióxido de carbono gaseoso para expandir el abdomen y ayudar a crear un espacio de trabajo más grande. Si se utilizan 4.80 L de gas CO2 a 18 °C a 785 mmHg, ¿cuál es el volumen final, en litros, del gas a 37 °C y una presión de 745 mmHg, si la cantidad de CO2 no cambia?
