Los gases tienen propiedades únicas que los distinguen de los sólidos y líquidos. Estas propiedades y su comportamiento pueden explicarse mediante la teoría cinético-molecular, que nos ayuda a comprender cómo las partículas de un gas interactúan y responden a cambios en la presión, volumen y temperatura. En esta clase, aprenderemos sobre las propiedades fundamentales de los gases y cómo medirlas, lo que nos permitirá entender mejor su comportamiento en diferentes contextos.
Objetivo de aprendizaje
Identificar y comprender las propiedades de los gases y su medición mediante el uso de la teoría cinético-molecular y conceptos prácticos.
1. Teoría cinético-molecular de los gases
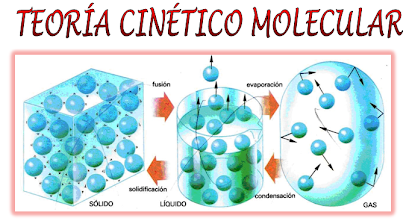
La teoría cinético-molecular describe el comportamiento de las partículas en un gas ideal y explica cómo sus propiedades están interrelacionadas. Los postulados básicos de esta teoría son:
- Las partículas de un gas están en constante movimiento y se mueven en línea recta hasta que chocan entre sí o con las paredes del recipiente.
- Las partículas de un gas no tienen un volumen significativo en comparación con el espacio total del gas.
- No hay fuerzas de atracción o repulsión entre las partículas de un gas ideal; sus colisiones son perfectamente elásticas.
- La temperatura de un gas está relacionada con la energía cinética promedio de sus partículas. A mayor temperatura, mayor velocidad de las partículas.
Esta teoría es clave para entender el comportamiento de los gases y cómo responden a cambios en condiciones externas.
2. Propiedades fundamentales de los gases
- Presión (P): La presión es la fuerza que las partículas de gas ejercen al chocar con las paredes del recipiente que las contiene. Se mide en pascales (Pa), atmósferas (atm) o milímetros de mercurio (mmHg). La fórmula de presión es:
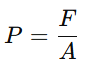
donde F es la fuerza y A es el área.
- Volumen (V): El volumen es el espacio que ocupa el gas y se mide en litros (L) o mililitros (mL). Los gases ocupan todo el volumen del recipiente que los contiene y, al expandirse, adoptan su forma.
- Temperatura (T): La temperatura es una medida de la energía cinética promedio de las partículas de un gas. Se mide en kelvins (K), aunque también es común medirla en grados Celsius (°C). La temperatura afecta directamente la velocidad de las partículas y, por lo tanto, la presión y el volumen del gas.
- Cantidad de Gas (n): La cantidad de gas se expresa en moles (mol), que representan la cantidad de partículas en el gas. La relación entre la cantidad de gas y otras propiedades se describe mediante la Ley de los Gases Ideales:
P V = n R T
donde R es la constante de los gases ideales (0.0821 L·atm/mol·K o 8.31 J/mol·K).
3. Unidades de medición y conversión de unidades
- Presión: Pascales (Pa), atmósferas (atm), milímetros de mercurio (mmHg), y bares (bar).
- Volumen: Litros (L), mililitros (mL).
- Temperatura: Kelvin (K) y grados Celsius (°C), donde K=°C+273.15K
- Cantidad de Gas: Moles (mol).
Estas unidades permiten medir y calcular las propiedades de los gases en diferentes situaciones, como cambios de presión o temperatura.
Actividad: “Moléculas en Movimiento”
Descripción:
“Moléculas en Movimiento” es una actividad interactiva diseñada para ayudar a los estudiantes a comprender los principios de la teoría cinética molecular. A través de una serie de juegos y desafíos físicos, los estudiantes explorarán cómo el movimiento y la energía de las partículas varían con los cambios en la temperatura y el estado de la materia.
Preparación:
Organiza el aula o un espacio al aire libre en varias “zonas de energía” que representen diferentes temperaturas: una zona fría, una zona templada y una zona caliente. Cada zona tendrá actividades que representen el nivel de actividad molecular en diferentes temperaturas.
Actividades:
- Zona Fría (Sólido): Los estudiantes deben moverse lentamente, representando cómo las moléculas en un sólido vibran, pero casi no se mueven de su lugar. En esta zona, los estudiantes deben “congelarse” y moverse lo más lentamente posible, para simular el comportamiento de las partículas en un sólido, donde se mueven muy poco.
- Zona Templada (Líquido): En esta zona, los estudiantes deben caminar a un ritmo moderado, representando cómo las moléculas de un líquido pueden deslizarse unas sobre otras, pero aún están relativamente cerca. Los estudiantes deben pasar una pelota o un objeto pequeño entre ellos, imitando el flujo de moléculas en un líquido.
- Zona Caliente (Gas): Aquí, los estudiantes se moverán libremente y rápidamente, corriendo o bailando para representar las moléculas de un gas que se mueven muy rápidamente y se dispersan. Se pueden chocar entre sí de manera suave, como las partículas de un gas en el aire.
Interacción y Aprendizaje:
Después de participar en las actividades de cada zona, los estudiantes se reúnen para discutir cómo cambió su movimiento en cada estado y qué efectos creen que la temperatura tuvo en la energía y el comportamiento de las “moléculas” (los estudiantes). Esta discusión ayudará a consolidar su entendimiento de cómo la energía térmica afecta el movimiento de las partículas según la teoría cinética molecular.
