El pH y el pOH son medidas fundamentales en la química que indican la acidez o alcalinidad de una solución. La escala de pH se utiliza para medir la concentración de iones de hidrógeno (H+) en una solución, mientras que la escala de pOH mide la concentración de iones hidróxido (OH−). Estas escalas son esenciales para comprender muchas reacciones químicas, biológicas y procesos industriales.
Objetivos de aprendizaje
- Comprender qué es el pH y el pOH, y cómo se calculan.
- Comprender la escala de pH y su rango.
- Aprender a medir el pH de diversas soluciones.
- Explorar la importancia del pH en la naturaleza, la industria y la biología.
- Realizar experimentos prácticos para medir y comparar el pH de diferentes sustancias.
1. Definición de pH y pOH
El pH es una medida de la concentración de iones de hidrógeno (H⁺) en una solución. La fórmula para calcular el pH es:
pH = −log[H+]
Donde [H+] es la concentración de iones de hidrógeno en moles por litro (M).
El pOH es una medida de la concentración de iones hidróxido (OH−) en una solución. La fórmula para calcular el pOH es:
pOH = −log[OH−]
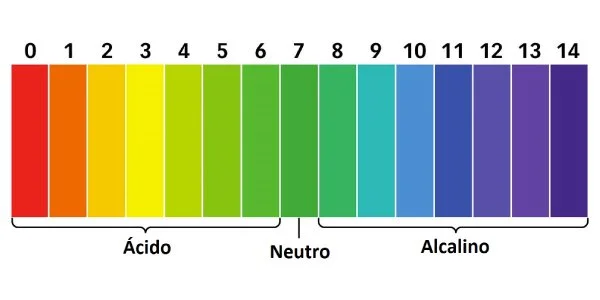
2. Rango de la Escala de pH
La escala de pH varía de 0 a 14:
- pH < 7: Solución ácida
- pH = 7: Solución neutra
- pH > 7: Solución básica (alcalina)
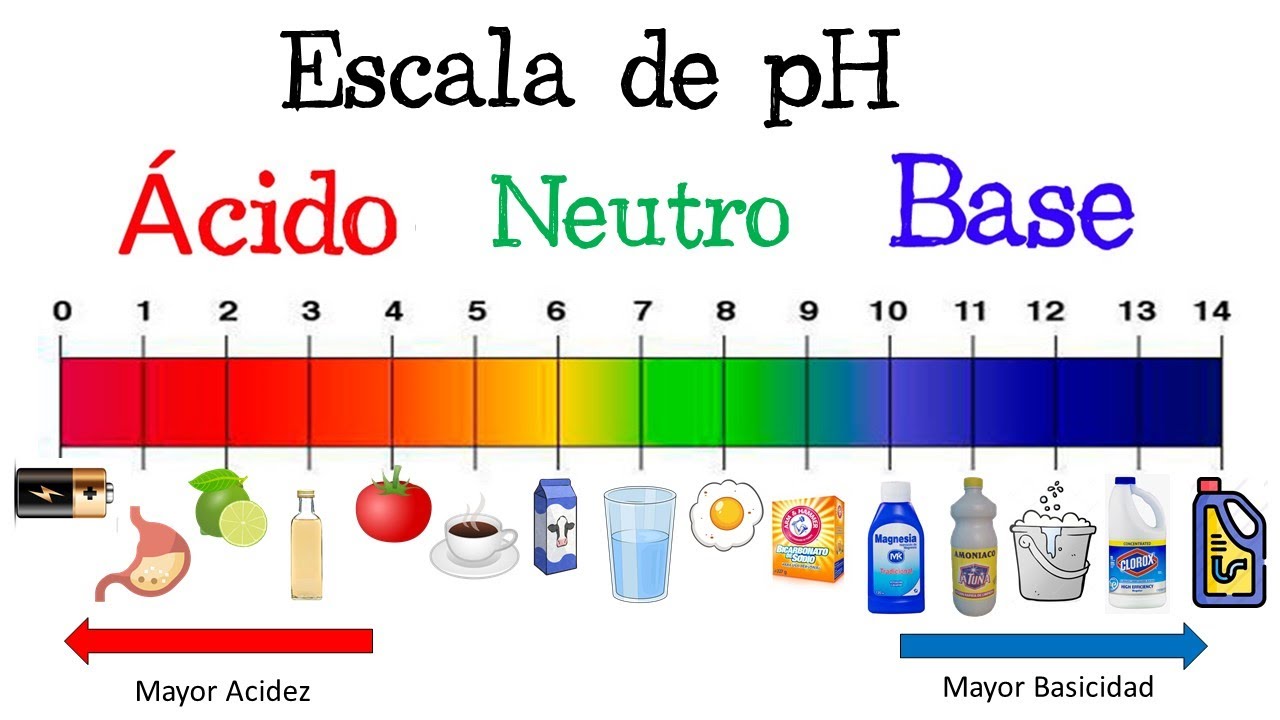
Cada unidad de pH representa un cambio de diez veces en la concentración de iones de hidrógeno.
3. Medición del pH
Métodos de medición:
Existen varios métodos para medir el pH de una solución:
- Papel de pH: Tiras de papel impregnadas con indicadores que cambian de color según el pH de la solución.
- Indicadores de pH Líquidos: Sustancias que cambian de color según el pH de la solución.
- pH-metros: Instrumentos electrónicos que miden el pH de una solución con precisión.
Procedimiento para medir el pH:
- Papel de pH:
- Sumerja una tira de papel de pH en la solución.
- Compare el color del papel con la escala de colores proporcionada.
- Anote el valor de pH correspondiente.
- Indicadores de pH Líquidos:
- Agregue unas gotas del indicador en la solución.
- Observe el cambio de color.
- Compare el color con la escala de colores proporcionada por el fabricante.
- Anote el valor de pH correspondiente.
- pH-metro:
- Calibre el pH-metro con soluciones buffer de pH conocido (generalmente pH 4, 7 y 10).
- Sumerja el electrodo del pH-metro en la solución.
- Lea el valor de pH en la pantalla digital.
- Anote el valor de pH.
4. Ejemplos de cómo calcular el pH de las soluciones
Ejemplo 1: La aspirina, que es ácido acetilsalicílico, fue el primer medicamento antiinflamatorio no esteroideo (AINE) utilizado para aliviar el dolor y la fiebre. Si una solución de aspirina tiene una [H3O+]=1,7×10−3 M ¿cuál es el pH de la solución?
Para calcular el pH de la solución, usamos la fórmula del pH: pH=−log[H3O+]
Dado que [H3O+] = 1,7×10−3 M,
pH = −log(1,7×10−3 M)
pH = 2,77
Ejemplo 2: Calcular la concentración de iones hidronio, [H3O+], en una muestra de orina con un pH de 7,5.
pH = −log[H3O+]
Dado que el pH es 7,5:
7,5 = −log[H3O+]
Para encontrar [H3O+], debemos invertir la función logarítmica:
[H3O+] = 10−pH
Sustituyendo el valor del pH:
[H3O+] = 10−7,5
Calculamos el valor numérico:
[H3O+] ≈ 3,16 × 10−8 M
Ejemplo 3: Calcular el pH y el pOH de una solución de hidróxido de sodio (NaOH) con una concentración de 0,001 M.
Solución:
[OH−] = 0,001 M
pOH = −log(0,001)
pOH = 3
pH = 14 − pOH
pH = 14 − 3
pH = 11
El pH es 11 y el pOH es 3.
5. Importancia del pH en diferentes contextos
pH en la naturaleza
- Aguas Naturales: El pH del agua de ríos, lagos y océanos es crucial para la vida acuática. El pH óptimo para la mayoría de los organismos acuáticos está entre 6,5 y 8,5.
- Suelo: El pH del suelo afecta la disponibilidad de nutrientes para las plantas. La mayoría de las plantas prefieren un pH del suelo entre 6 y 7,5.
pH en la industria
- Alimentos y Bebidas: El pH es crucial en la producción de alimentos y bebidas para garantizar la calidad y seguridad del producto. Por ejemplo, el pH del vino y la cerveza afecta su sabor y estabilidad.
- Productos Químicos: El pH debe controlarse en la producción de productos químicos para garantizar la eficacia y seguridad del producto final.
- Tratamiento de Aguas: El pH del agua potable y de las aguas residuales debe controlarse para evitar la corrosión de las tuberías y para asegurar la eficiencia de los procesos de tratamiento.
pH en la biología y la salud
- Sangre Humana: El pH de la sangre debe mantenerse en un rango muy estrecho de 7,35 a 7,45. Desviaciones significativas pueden ser peligrosas y causar acidosis o alcalosis.
- Digestión: El pH del estómago es muy ácido (alrededor de 1,5 a 3,5) para ayudar en la digestión de los alimentos y matar bacterias.
- Productos Cosméticos: El pH de los productos para la piel y el cabello debe ser compatible con el pH natural de la piel (alrededor de 5,5) para evitar irritaciones.
En resumen, la escala de pH es una herramienta esencial en química que mide la acidez o alcalinidad de una solución. Comprender el pH es crucial para diversas aplicaciones en la ciencia, la industria, la biología y la vida cotidiana. A través de la teoría y la práctica, los estudiantes pueden aprender a medir y analizar el pH de diversas soluciones, y entender su importancia en diferentes contextos.
Ejercicios de práctica
1. Indique si cada uno de las siguientes sustancias es ácida, básica o neutra:
a) Plasma sanguíneo, pH 7,38
b) Vinagre, pH 2,8
c) Limpiador de desagües, pH 11,2
d) Café, pH 5,52
e) Tomates, pH 4,2
f) Pastel de chocolate, pH 7,6
2. Calcule el pH de cada solución dada la siguiente concentración de [H3O+]:
a) [H3O+] = 1×10−4 M
b) [H3O+] = 3×10−9 M
3. Un paciente con acidosis metabólica severa tiene un pH de plasma sanguíneo de 6,92. ¿Cuál es la concentración de [H3O+] del plasma sanguíneo?
4. Completa la siguiente tabla:
| [H3O+] | [OH−] | pH | pOH | ¿Ácido, básico o neutro? |
|---|---|---|---|---|
| 1,0×10−6 M | ||||
| 3,49 | ||||
| Neutro | ||||
| 2,8×10−5 M |
Laboratorio: Medición del pH usando col morada
Introducción
La col morada contiene antocianinas, compuestos que cambian de color según el pH de la solución. Este experimento utilizará extracto de col morada como indicador de pH natural para medir el pH de diversas soluciones.
Objetivos
- Medir el pH de varias soluciones usando el indicador de col morada.
- Comprender la relación entre el color del indicador y el pH de la solución.
Materiales necesarios
- 1 cabeza de col morada.
- Cuchillo y tabla para cortar la col morada.
- Alcohol.
- Mortero y pistilo.
- Filtro de café o colador fino.
- Varios vasos de precipitados o vasos transparentes.
- Pipetas, jeringas o goteros.
- Papel pH o pH-metro (opcional para comparación)
- Soluciones a medir:
- Agua oxigenada
- Vinagre
- Jugo de limón
- Lejía
- Polvo de hornear
- Zumo de naranja
- Detergente
- Leche
- Cloro
- Agua destilada
Procedimiento
- Parte 1: Preparación del indicador de col morada
- Cortar la col morada en pequeños trozos.
- Colocar los trozos de col en el mortero y aplastar.
- Extraer el líquido de la col morada usando un filtro de café o colador fino.
- Verter el contenido del extracto de la col morada en un gotero. Agregar alcohol y reservar.
- El líquido resultante es el extracto de col morada, que actuará como indicador de pH.
- Parte 2: Medición del pH de las soluciones
- Preparación de las soluciones:
- Llenar varios vasos de precipitados o vasos transparentes con las soluciones a medir (aproximadamente 50 ml de cada solución).
- Llenar varios vasos de precipitados o vasos transparentes con las soluciones a medir (aproximadamente 50 ml de cada solución).
- Adición del indicador:
- Añade aproximadamente 10 ml del extracto de col morada a cada vaso con una pipeta o gotero.
- Añade aproximadamente 10 ml del extracto de col morada a cada vaso con una pipeta o gotero.
- Observación del Cambio de Color:
- Observa y anota el color resultante de cada solución después de añadir el indicador de col morada.
- Observa y anota el color resultante de cada solución después de añadir el indicador de col morada.
- Determinación del pH:
- Compara los colores observados con la escala de colores del indicador de col lombarda proporcionada a continuación para estimar el pH de cada solución.
- Parte 3: Escala de colores del indicador de col morada
Resultados y Análisis
- Registro de Resultados:
- Completa una tabla con las soluciones, el color observado y el pH estimado.
| Solución | Color observado | pH estimado |
|---|---|---|
| Vinagre | ||
| Agua oxigenada | ||
| Lejía | ||
| Jugo de Limón | ||
| Polvo de hornear | ||
| Detergente | ||
| Zumo de naranja | ||
| Agua Destilada | ||
| Leche | ||
| Cloro |
- Comparación con Medidas de pH:
- Si dispones de papel pH o un pH-metro, mide el pH de cada solución y compáralo con los valores estimados usando el indicador de col lombarda.
Conclusiones
- Resume los resultados del experimento.
- Discute la precisión del indicador de col morada en comparación con otras herramientas de medición de pH.
- Reflexiona sobre las aplicaciones prácticas del uso de indicadores naturales.
Preguntas para Reflexionar
- ¿Qué tan preciso es el indicador de col morada en comparación con el papel pH o el pH-metro?
- ¿Por qué es importante medir el pH de las soluciones en diferentes contextos (por ejemplo, en el medio ambiente, en la industria alimentaria, en la salud)?
- ¿Qué otras plantas o alimentos podrían usarse como indicadores naturales de pH?
- ¿Cómo podrías mejorar este experimento para obtener resultados más precisos o detallados?
- ¿Cuál es la importancia de entender el pH de los productos de limpieza doméstica y su impacto potencial en la salud y el medio ambiente?
- ¿De qué manera el conocimiento del pH puede ser útil en la preparación de alimentos y bebidas?
- ¿Cómo podrías utilizar indicadores de pH naturales en un proyecto de ciencia en casa o en la escuela?
Seguridad en el Laboratorio
- Usa guantes y gafas de seguridad durante el experimento.
- Manipula todas las soluciones con cuidado y evita el contacto con la piel y los ojos.
- Limpia todas las superficies y equipos después de completar el experimento.
