
La química orgánica es una rama fundamental de la química que se enfoca en el estudio de los compuestos que contienen carbono.
Esta clase introductoria cubrirá conceptos esenciales sobre el carbono, la historia de la química orgánica, características de los compuestos orgánicos y sus propiedades, así como ejemplos comunes de estos compuestos. También exploraremos las diversas formas de representar los compuestos carbonados.
Objetivo de aprendizaje
- Comprender las características del elemento carbono y su importancia en la química orgánica.
- Diferenciar las propiedades físicas y químicas entre compuestos orgánicos e inorgánicos.
1. El Carbono. Características
- Número atómico y estructura atómica
El número atómico del carbono es 6, lo que significa que tiene 6 protones en su núcleo. En su estado fundamental, el carbono también tiene 6 electrones distribuidos en dos niveles de energía (2 en el primer nivel y 4 en el segundo nivel).
- Masa atómica relativa
La masa atómica relativa del carbono es aproximadamente 12 u, ya que su isótopo más abundante, el carbono-12, tiene 6 protones y 6 neutrones.
- Característica sobresaliente
Una característica sobresaliente del carbono es su capacidad para formar cuatro enlaces covalentes con otros átomos, e inclusive, del mismo elemento, lo que le permite formar una variedad casi infinita de compuestos moleculares.
- Alótropos del carbono
Un alótropo es una forma diferente de un mismo elemento en el mismo estado físico. Los alótropos del carbono incluyen:
Diamante: Estructura cristalina rígida.
Grafito: Capas de átomos de carbono que pueden deslizarse entre sí.
Grafeno: Una sola capa de átomos de carbono en una estructura bidimensional.
Fullerenos: Moléculas esféricas o tubulares de carbono.
2. Historia de la química orgánica
- Teoría de la “Fuerza Vital”
La teoría que sostenía que los compuestos orgánicos solo se podían crear a partir de una “fuerza vital” presente en los seres vivos se llamaba “vitalismo“.
- Clasificación de los Compuestos Químicos
A principios del siglo XIX, los compuestos químicos se clasificaban en dos grupos principales: compuestos orgánicos y compuestos inorgánicos.
- Clasificación por Berzelius
El científico sueco Jöns Jacob Berzelius realizó esta clasificación. Según esta clasificación inicial:
- Los compuestos inorgánicos provenían de minerales y no estaban relacionados con organismos vivos.
- Los compuestos orgánicos provenían de organismos vivos y contenían la “fuerza vital”.
- Experimento de Wöhler
Friedrich Wöhler derribó la teoría de la “fuerza vital” al sintetizar úrea, un compuesto orgánico, a partir de un compuesto inorgánico, cianato de amonio, en 1828:
NH4OCN → (NH2)2CO
Este experimento demostró que los compuestos orgánicos podían ser sintetizados a partir de compuestos inorgánicos.
3. Química orgánica
La química orgánica es la rama de la química que estudia los compuestos del carbono, incluidos sus propiedades, estructuras, reacciones y síntesis. Los compuestos orgánicos contienen principalmente carbono e hidrógeno, y a veces otros no metales como oxígeno, azufre, nitrógeno, fósforo o un halógeno.
Como se dijo anteriormente, el carbono es único debido a su capacidad para formar cuatro enlaces covalentes estables con otros átomos, permitiendo la formación de cadenas y estructuras complejas. Por ende, encontramos muchos compuestos orgánicos en productos comunes que usamos todos los días, como gasolina, medicamentos, champús, plásticos y perfumes. Los alimentos que comemos están compuestos por compuestos orgánicos como carbohidratos, grasas y proteínas que nos proporcionan combustible para obtener energía y los átomos de carbono necesarios para construir y reparar las células de nuestro cuerpo.
Las fórmulas de los compuestos orgánicos se escriben con el carbono primero, seguido del hidrógeno y luego de cualquier otro elemento. Por ejemplo, la fórmula del etano es C2H6.
4. Ejemplos de compuestos orgánicos
La úrea
La úrea ((NH2)2CO) es un compuesto orgánico que se encuentra en la orina de los mamíferos y es importante en el metabolismo del nitrógeno.
Alimentos
Los alimentos que consumimos están compuestos por carbohidratos, proteínas y lípidos, todos ellos compuestos orgánicos.
Hidrocarburos
Los hidrocarburos son compuestos formados exclusivamente por carbono e hidrógeno. Ejemplos incluyen el metano (CH4) y el etano (C2H6).
Productos de uso cotidiano
Cinco productos cotidianos que representan compuestos orgánicos son:
- Plásticos
- Combustibles (gasolina, diésel)
- Medicamentos
- Jabones y detergentes
- Alimentos procesados
4. Diferencias entre compuestos orgánicos e inorgánicos
Este cuadro comparativo destaca las principales diferencias entre los compuestos orgánicos e inorgánicos, proporcionando ejemplos claros y propiedades específicas para cada tipo de compuesto.
| Propiedad | Orgánicos | Ejemplo: C₃H₈ | Inorgánicos | Ejemplo: NaCl |
|---|---|---|---|---|
| Elementos presentes | C y H, a veces O, S, N, P o halógenos (F, Cl, Br, I) | C y H | La mayoría de los metales y no metales | Na y Cl |
| Partículas | Moléculas | C₃H₈ | Mayormente iones | Na⁺ y Cl⁻ |
| Tipo de enlace | Mayormente covalente | Covalente | Muchos son iónicos, algunos covalentes | Iónico |
| Polaridad de los enlaces | No polar a menos que haya un átomo fuertemente electronegativo | No polar | La mayoría son iónicos o covalentes polares, algunos covalentes no polares | Iónico |
| Punto de fusión | Generalmente bajo | -188 °C | Generalmente alto | 801 °C |
| Punto de ebullición | Generalmente bajo | -42 °C | Generalmente alto | 1413 °C |
| Inflamabilidad | Alta, arden en el aire | Sí | Baja, no arden | No |
| Solubilidad en agua | No solubles a menos que haya un grupo polar presente | No | La mayoría son solubles a menos que sean no polares | Sí |
5. Tipos de representaciones de los compuestos carbonados
Los hidrocarburos son compuestos orgánicos que consisten únicamente en carbono e hidrógeno. En las moléculas orgánicas, cada átomo de carbono tiene cuatro enlaces. En el hidrocarburo más simple, el metano (CH4), el átomo de carbono forma un octeto compartiendo sus cuatro electrones de valencia con cuatro átomos de hidrógeno.
La representación más precisa del metano es el modelo tridimensional de llenado de espacio (a), en el cual las esferas muestran el tamaño y la forma relativos de todos los átomos.
Otro tipo de representación tridimensional es el modelo de bolas y varillas (b), donde los átomos se representan como bolas y los enlaces entre ellos se muestran como varillas. En el modelo de bolas y varillas del metano, CH4, los enlaces covalentes del átomo de carbono a cada átomo de hidrógeno están dirigidos a las esquinas de un tetraedro con ángulos de enlace de 109°.
En el modelo de cuñas y guiones (c), la forma tridimensional se representa mediante símbolos de los átomos con líneas para los enlaces en el plano de la página, cuñas para los enlaces que proyectan hacia fuera de la página y guiones para los enlaces que están detrás de la página.
Sin embargo, los modelos tridimensionales son difíciles de dibujar y visualizar para moléculas más complejas. Por lo tanto, es más práctico usar sus fórmulas bidimensionales correspondientes.
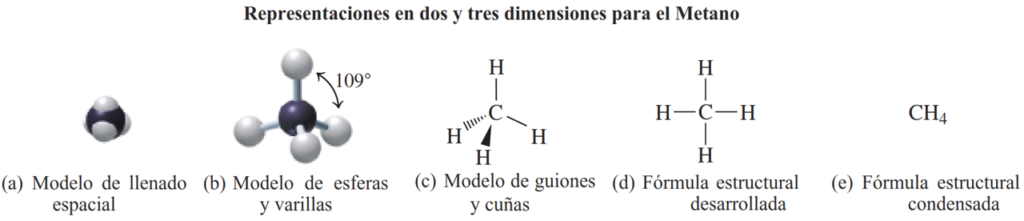
La fórmula estructural desarrollada (d) muestra todos los átomos y los enlaces conectados a cada átomo.
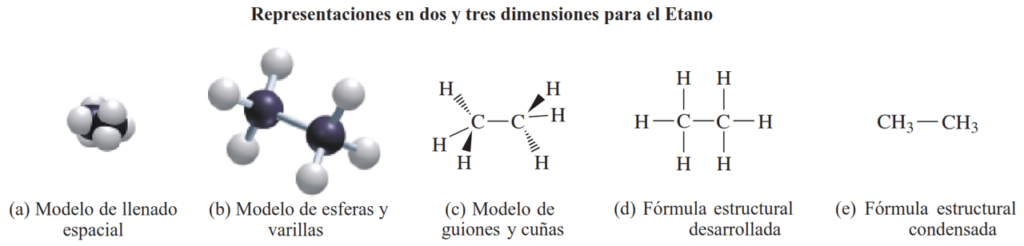
Una fórmula estructural condensada (e) muestra los átomos de carbono, cada uno agrupado con el número de átomos de hidrógeno adjuntos. El hidrocarburo etano, con dos átomos de carbono y seis átomos de hidrógeno, puede ser representado por un conjunto similar de modelos y fórmulas tridimensionales y bidimensionales, en los cuales cada átomo de carbono está enlazado a otro carbono y a tres átomos de hidrógeno. Al igual que en el metano, cada átomo de carbono en el etano mantiene una forma tetraédrica. Un hidrocarburo se denomina saturado cuando todos los enlaces en la molécula son enlaces simples.
Esta primera clase de química orgánica nos ha introducido al mundo de los compuestos orgánicos, el papel fundamental del carbono, la historia de la química orgánica y las propiedades distintivas de los compuestos orgánicos e inorgánicos. Hemos aprendido sobre la importancia de los compuestos orgánicos en la vida diaria y las diversas formas de representar estos compuestos. Este conocimiento básico es esencial para avanzar en el estudio de la química orgánica y sus aplicaciones.
Actividad: Propiedades de compuestos orgánicos e inorgánicos
1. Identifica cada uno de los siguientes compuestos como orgánico o inorgánico:
a) KCl
b) C3H7Cl
c) Es soluble en agua
d) Tiene un punto de ebullición bajo
e) Contiene carbono e hidrógeno
f) Contiene enlaces iónicos
g) Contiene Li y F
h) K3PO4
i) Contiene enlaces covalentes
j) Produce iones en agua
k) Es un gas a temperatura ambiente
l) C4H9Br
2. Asocia cada una de las siguientes propiedades físicas y químicas con el etano, C2H6, o bromuro de sodio, NaBr:
a) Hierve a -89 °C
b) Arde vigorosamente en el aire
c) Es sólido a 250 °C
d) Se disuelve en agua
