
Los alcanos son hidrocarburos saturados que contienen únicamente enlaces simples (sigma) entre átomos de carbono. La fórmula general para los alcanos acíclicos (lineales o ramificados) es CnH2n+2.
En esta clase, exploraremos la definición de los alcanos, sus usos, su nomenclatura y representación estructural, así como una breve introducción a los cicloalcanos.
Objetivo de aprendizaje
- Escribir los nombres IUPAC y representar las fórmulas estructurales condensadas y de línea de ángulo para los alcanos.
1. Hidrocarburos
Los hidrocarburos son compuestos que contienen los elementos carbono e hidrógeno. Los alcanos son una clase fundamental de compuestos orgánicos que se caracterizan por tener enlaces simples entre átomos de carbono. Son también conocidos como hidrocarburos saturados.
Clasificación de los hidrocarburos:

2. Alcanos más comunes y sus usos
Metano (CH₄)
- Usos: Principal componente del gas natural, utilizado como combustible doméstico e industrial.
Etano (C₂H₆)
- Usos: Utilizado en la producción de etileno, que a su vez se utiliza para fabricar plásticos.
Propano (C₃H₈)
- Usos: Utilizado como combustible para calentadores y estufas, y como propano líquido en tanques para barbacoa.
Butano (C₄H₁₀)
- Usos: Utilizado como combustible para encendedores y en mezclas de gas para calefacción.
Pentano (C₅H₁₂)
- Usos: Utilizado como disolvente en laboratorios y en la producción de espuma de poliestireno.
Hexano (C₆H₁₄)
- Usos: Utilizado como disolvente industrial y en la extracción de aceites vegetales.
Heptano (C₇H₁₆)
- Usos: Utilizado en laboratorios como disolvente no polar y en pruebas de octanaje para la gasolina.
Octano (C₈H₁₈)
- Usos: Principal componente de la gasolina, su número de octano determina la calidad del combustible.
Nonano (C₉H₂₀)
- Usos: Utilizado como disolvente y en la fabricación de lubricantes.
Decano (C₁₀H₂₂)
- Usos: Utilizado como disolvente, en productos de limpieza y en la producción de combustibles.
3. Nombres IUPAC y fórmulas para los primeros diez alcanos
Como pudimos apreciar, los nombres de los alcanos terminan en “ano“. Dichos nombres son parte del sistema IUPAC (Unión Internacional de Química Pura y Aplicada) utilizado por los químicos para nombrar compuestos orgánicos. Los alcanos con cinco o más átomos de carbono en una cadena se nombran usando prefijos griegos: pent (5), hex (6), hept (7), oct (8), non (9) y dec (10).
| Número de Carbonos | Nombre IUPAC | Fórmula Molecular | Fórmula Condensada |
|---|---|---|---|
| 1 | Metano | CH₄ | CH₄ |
| 2 | Etano | C₂H₆ | CH₃-CH₃ |
| 3 | Propano | C₃H₈ | CH₃-CH₂-CH₃ |
| 4 | Butano | C₄H₁₀ | CH₃-CH₂-CH₂-CH₃ |
| 5 | Pentano | C₅H₁₂ | CH₃-CH₂-CH₂-CH₂-CH₃ |
| 6 | Hexano | C₆H₁₄ | CH₃-CH₂-CH₂-CH₂-CH₂-CH₃ |
| 7 | Heptano | C₇H₁₆ | CH₃-CH₂-CH₂-CH₂-CH₂-CH₂-CH₃ |
| 8 | Octano | C₈H₁₈ | CH₃-CH₂-CH₂-CH₂-CH₂-CH₂-CH₂-CH₃ |
| 9 | Nonano | C₉H₂₀ | CH₃-CH₂-CH₂-CH₂-CH₂-CH₂-CH₂-CH₂-CH₃ |
| 10 | Decano | C₁₀H₂₂ | CH₃-CH₂-CH₂-CH₂-CH₂-CH₂-CH₂-CH₂-CH₂-CH₃ |
4. Fórmulas estructurales condensadas y de líneas y ángulos para los alcanos
En una fórmula estructural condensada, cada átomo de carbono y sus átomos de hidrógeno adjuntos se escriben como un grupo. Un subíndice indica el número de átomos de hidrógeno unidos a cada átomo de carbono.
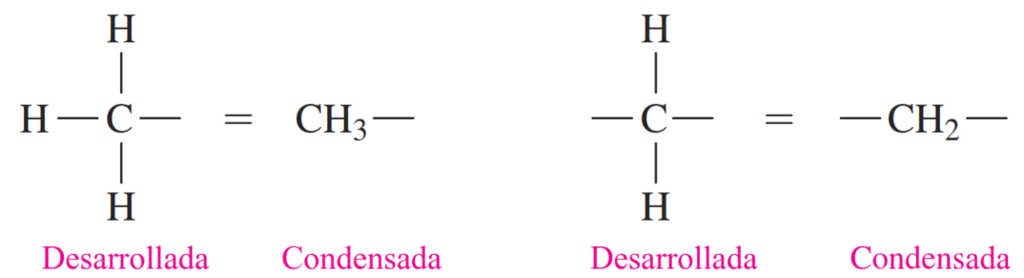
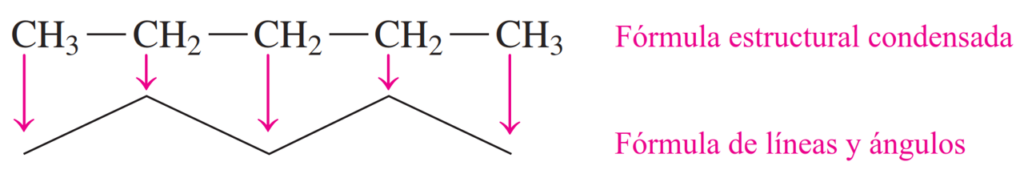
Cuando una molécula orgánica consiste en una cadena de tres o más átomos de carbono, los átomos de carbono no están dispuestos en línea recta. Más bien, se disponen en un patrón de zigzag.
Una fórmula simplificada llamada fórmula de líneas y ángulos muestra una línea en zigzag en la cual los átomos de carbono están representados como los extremos de cada línea y como esquinas. Por ejemplo, en la fórmula de líneas y ángulos del pentano, cada línea en el dibujo en zigzag representa un enlace simple. Los átomos de carbono en los extremos están unidos a tres átomos de hidrógeno. Sin embargo, los átomos de carbono en el medio de la cadena de carbono están unidos a dos átomos de carbono y dos átomos de hidrógeno.
Ejemplo: Representa las fórmulas estructurales desarrollada, condensada y de ángulo lineal del pentano.
Paso 1. Dibuje la cadena carbonada. Una molécula de pentano tiene cinco átomos de carbono en una cadena continua.
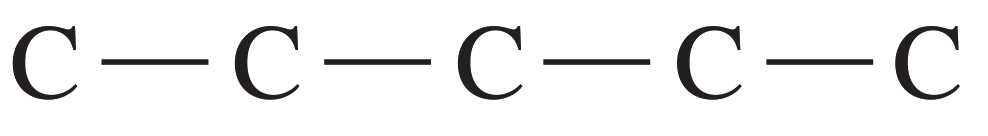
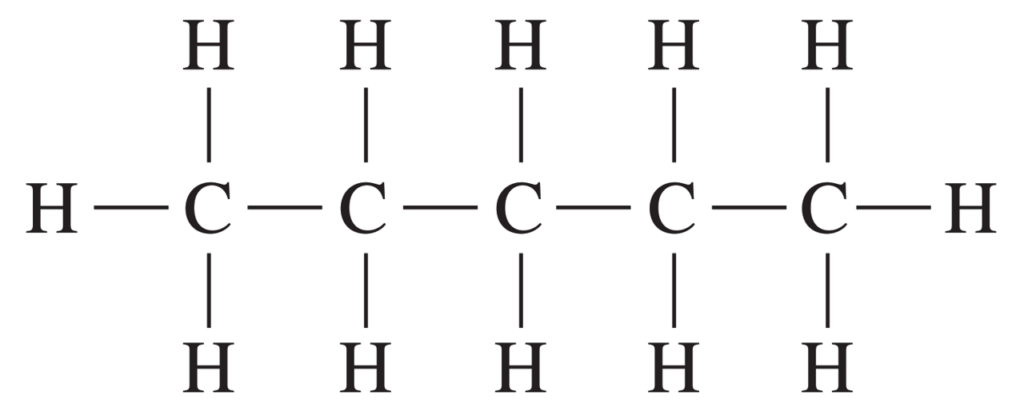
Paso 2. Dibuje la fórmula estructural desarrollada añadiendo los átomos de hidrógeno utilizando enlaces simples con cada uno de los átomos de carbono.
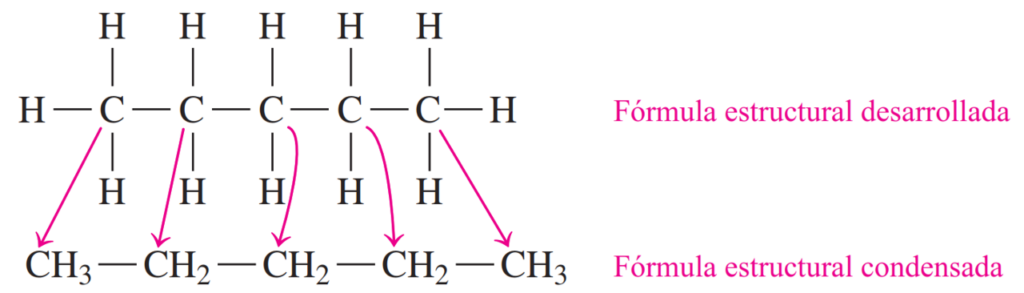
Paso 3. Dibuje la fórmula estructural condensada combinando los átomos de H con cada átomo de C.
Paso 4. Dibuja la fórmula de líneas y ángulos como una línea en zigzag en la que los extremos y las esquinas representan átomos de C.
5. Sustituyentes y radicales
La nomenclatura de los compuestos orgánicos se basa en el número de átomos de carbono que forman parte de la estructura y en el tipo y posición ocupada por los grupos funcionales presentes. Antes de mencionar las reglas para nombrar estos compuestos, es importante definir algunos conceptos básicos:
Sustituyente: Átomo o grupo de átomos que se encuentran unidos a una cadena hidrocarbonada, reemplazando un átomo de hidrógeno correspondiente al alcano. Por ejemplo, si en la molécula de metano (CH4), uno de los hidrógenos es reemplazado por un átomo de cloro, este será un sustituyente en la molécula original.
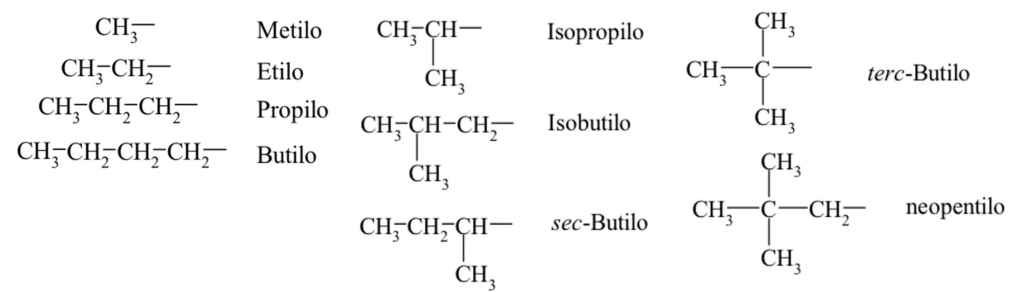
Radical: Átomo o grupo de átomos que poseen un electrón desapareado. Son altamente reactivos y suelen encontrarse como sustituyentes de moléculas mayores. Si se trata de un hidrocarburo que ha perdido uno de los hidrógenos, el radical se denomina grupo alquilo. Por ejemplo, el radical correspondiente al metano es el grupo metilo, CH3-. Observa que la terminación “-ilo” hace referencia a que se trata de un radical.
6. Nomenclatura de alcanos
En el sistema IUPAC de nomenclatura, un nombre está formado por tres partes: prefijos, principal y sufijos; Los prefijos indican los sustituyentes de la molécula; el sufijo indica el grupo funcional de la molécula; y la parte principal el número de carbonos que posee.

[1] isobutano (nombre común); metilpropano (nombre IUPAC)
[2] isopentano (nombre común); metilbutano (nombre IUPAC)
Los alcanos se pueden nombrar siguiendo siete etapas:
Regla 1.- Determinar el número de carbonos de la cadena más larga, llamada cadena principal del alcano. Obsérvese en las figuras que no siempre es la cadena horizontal.
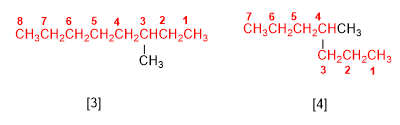
[3] 3-metiloctano
[4] 4-metilheptano
El nombre del alcano se termina en el nombre de la cadena principal (octano, heptano) y va precedido por los sustituyentes.
Regla 2.- Los sustituyentes se nombran cambiando la terminación –ano del alcano del cual derivan por –ilo (metilo, etilo, propilo, butilo). En el nombre del alcano, los sustituyentes preceden al nombre de la cadena principal, y se acompañan de un localizador que indica su posición dentro de la cadena principal. La numeración de la cadena principal se realiza de modo que al sustituyente se le asigne el localizador más bajo posible.
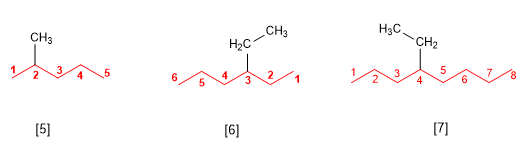
[5] 2-Metilpentano
[6] 3-Etilhexano
[7] 4-Etiloctano
Regla 3.- Si tenemos varios sustituyentes se ordenan alfabéticamente precedidos por lo localizadores. La numeración de la cadena principal se realiza para que los sustituyentes en conjunto tomen los menores localizadores.
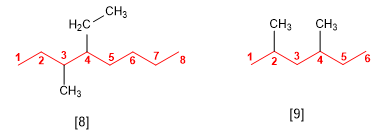
[8] 4-Etil-3-metiloctano
[9] 2,4-Dimetilhexano
Si varios sustituyentes son iguales, se emplean los prefijos di, tri, tetra, penta, hexa, para indicar el número de veces que aparece cada sustituyente en la molécula. Los localizadores se separan por comas y debe haber tantos como sustituyentes.
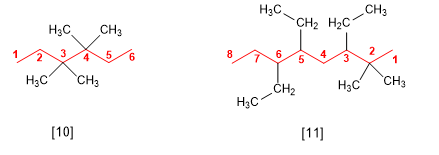
[10] 3,3,4,4-Tetrametilhexano
[11] 3,5,6-Trietil-2,2-dimetiloctano
Los prefijos de cantidad no se tienen en cuenta al ordenar alfabéticamente.
Regla 4.- Si al numerar la cadena principal por ambos extremos, nos encontramos a la misma distancia con los primeros sustituyentes, nos fijamos en los demás sustituyentes y numeramos para que tomen los menores localizadores.
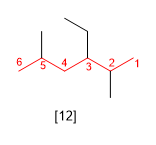
[12] 3-Etil-2,5-dimetilhexano
Regla 5.- Si al numerar en ambas direcciones se obtienen los mismos localizadores, se asigna el localizador más bajo al sustituyente que va primero en el orden alfabético.
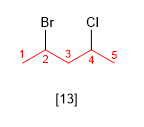
[13] 2-Bromo-4-cloropentano
Regla 6.- Si dos a más cadenas tienen igual longitud, se toma como principal la que tiene mayor número de sustituyentes.
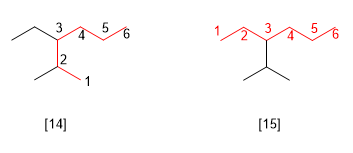
[14] 3-Etil-2-metilhexano (correcto)
[15] 3-Isopropilhexano (incorrecto)
Regla 7.- Existen algunos sustituyentes con nombres comunes aceptados por la IUPAC, aunque se recomienda el uso de la nomenclatura sistemática.
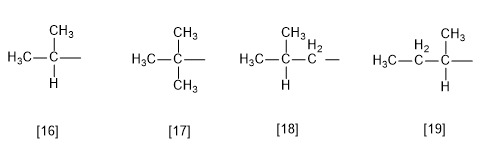
[16] Isobutilo (1-metiletilo)
[17] tert-butilo (1,1-dimetiletilo)
[18] Isobutilo (2-metilpropilo)
[19] sec-butilo (1-metilpropilo)
Los nombres sistemáticos de estos sustituyentes se obtienen numerando la cadena comenzando por el carbono que se une a la principal. El nombre del sustituyente se forma con el nombre de la cadena más larga terminada en –ilo, anteponiendo los nombres de los sustituyentes que tenga dicha cadena secundaria ordenados alfabéticamente. Veamos un ejemplo:
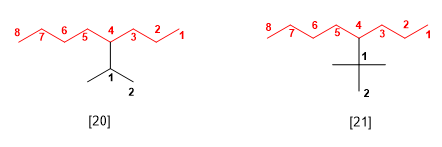
[20] 4-Isopropiloctano (4-(1-metiletil)octano)
[21] 4-tert-butiloctano (4-(1,1-dimetiletil)octano)
Los alcanos son una clase esencial de compuestos orgánicos con numerosas aplicaciones prácticas. La comprensión de su nomenclatura, estructura y propiedades es fundamental en el estudio de la química orgánica. Además, los cicloalcanos amplían la diversidad de estructuras posibles en la química del carbono, lo que permite una mayor variedad de compuestos y reacciones. Esta clase proporciona una base sólida para explorar más a fondo los hidrocarburos y otros compuestos orgánicos en futuras lecciones.
7. Isómeros estructurales
Un isómero es una de dos o más moléculas que tienen la misma fórmula molecular pero diferentes disposiciones de átomos en el espacio, lo que les confiere diferentes propiedades físicas y químicas. La existencia de isómeros es un fenómeno clave en la química orgánica y es crucial para la diversidad de compuestos que contienen carbono.
Un isómero estructural (también conocido como isómero constitucional) es un tipo de isómero en el cual las moléculas comparten la misma fórmula molecular pero tienen diferentes conexiones o enlaces entre los átomos dentro de la molécula. Esto significa que los átomos están conectados de manera diferente, lo que resulta en diferentes estructuras químicas y, por lo tanto, diferentes propiedades físicas y químicas.
Ejemplos de Isómeros Estructurales
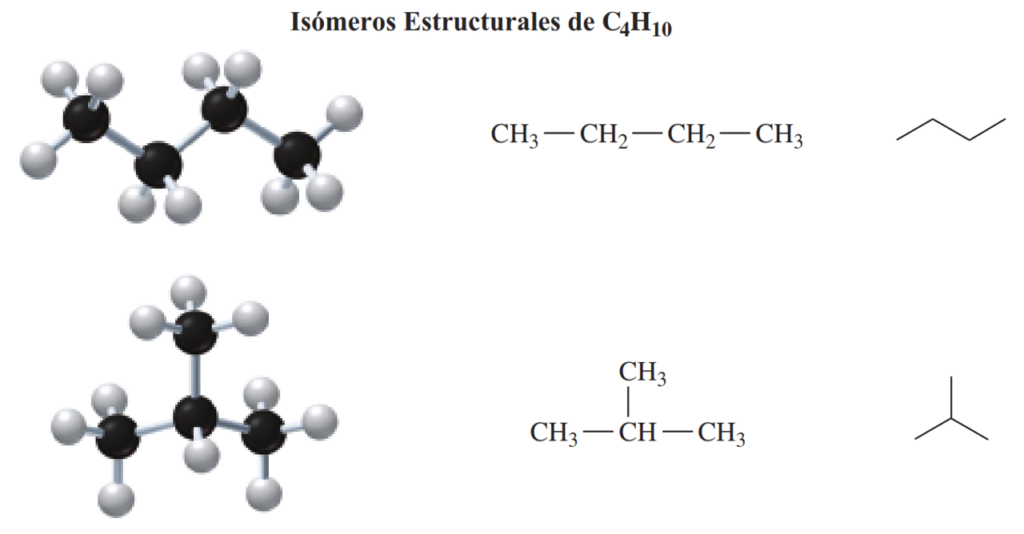
- Butano (C₄H₁₀):
- n-Butano: CH₃-CH₂-CH₂-CH₃
- Isobutano (2-metilpropano): (CH₃)₂CH-CH₃
Ambas moléculas tienen la misma fórmula molecular, C₄H₁₀, pero los átomos de carbono están conectados de manera diferente en cada molécula, lo que les da diferentes estructuras y propiedades.
Ejemplo: Identifica cada par de fórmulas como isómeros estructurales o la misma molécula.
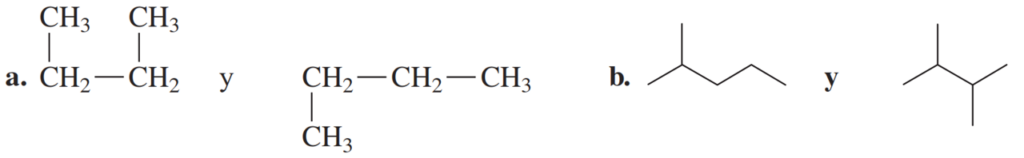
a. Ambos tienen la misma fórmula molecular C₄H₁₀. Ambos tienen cadenas continuas de cuatro carbonos, aunque los grupos -CH₃ se dibujen por encima o por debajo de la cadena. Por lo tanto, ambas fórmulas representan la misma molécula.
b. Ambos tienen la misma fórmula molecular C₆H₁₄. La fórmula de la izquierda tiene una cadena de cinco carbonos con un sustituyente -CH₃ en el segundo carbono de la cadena. La fórmula de la derecha tiene una cadena de cuatro carbonos con dos sustituyentes -CH₃. Por lo tanto, hay un orden diferente de enlace de átomos, lo que representa isómeros estructurales.
Ejercicios de práctica
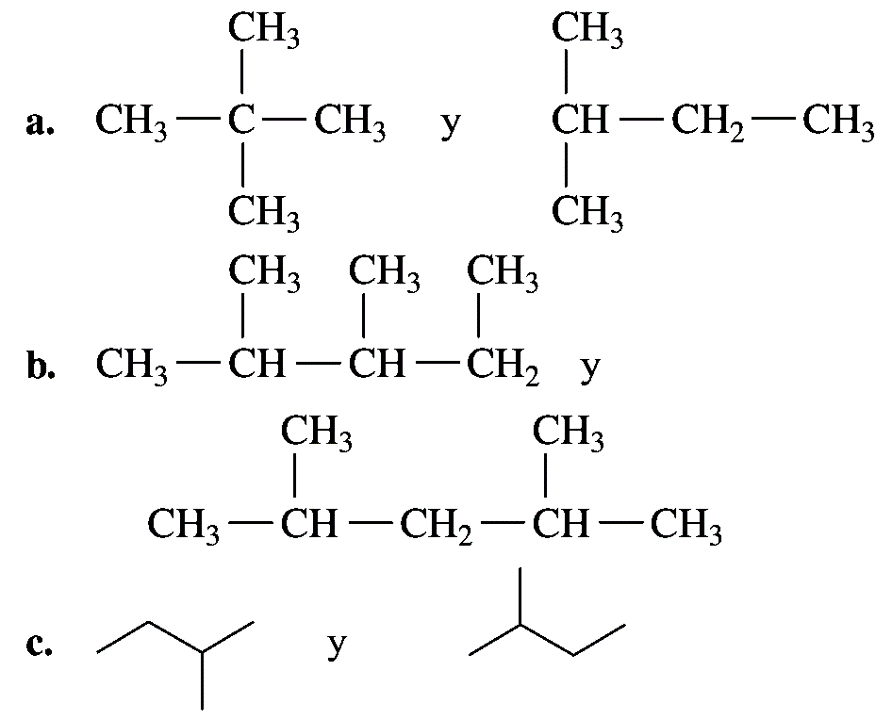
1. Indique si cada uno de los pares siguientes representa isómeros estructurales o la misma molécula:
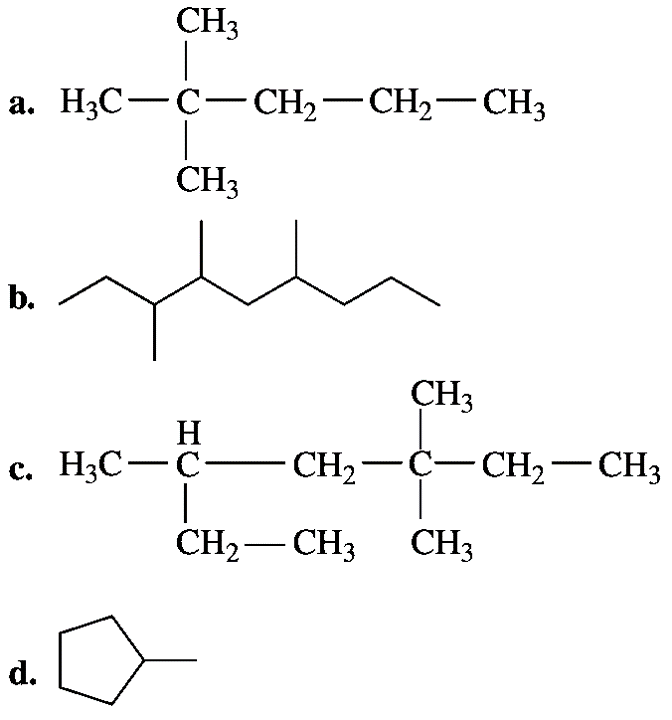
2. Indique el nombre IUPAC de cada una de las siguientes sustancias:
3. Dibuja la fórmula estructural condensada para cada uno de los siguientes alcanos:
a) 2, 3-dimetilbutano
b) 2, 2-dimetilpropano
c) 4-etil-2,3-dimetilhexano
d) 2-bromo-4-cloropentano
4. Dibuja la fórmula esqueletal para cada uno de los siguientes:
a) 3-metilhexano
b) 1-cloro-3-metilbutano
c) etilciclopropano
d) 3-cloroheptano
5. Representa los tres isómeros del pentano, C5H12.
