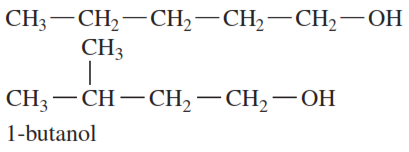Los alcoholes, al igual que los hidrocarburos, sufren combustión en presencia de oxígeno. Por ejemplo, en un restaurante, se puede preparar un postre flambeado vertiendo licor sobre frutas o helado y encendiéndolo. La combustión del etanol en el licor ocurre de la siguiente manera:
CH3CH2OH + 3O2 → 2CO2 + 3H2O + energía
Objetivo de aprendizaje
- Escribir ecuaciones químicas balanceadas para la combustión, deshidratación y oxidación de alcoholes.
- Escribir ecuaciones químicas balanceadas para la reducción de aldehídos y cetonas.
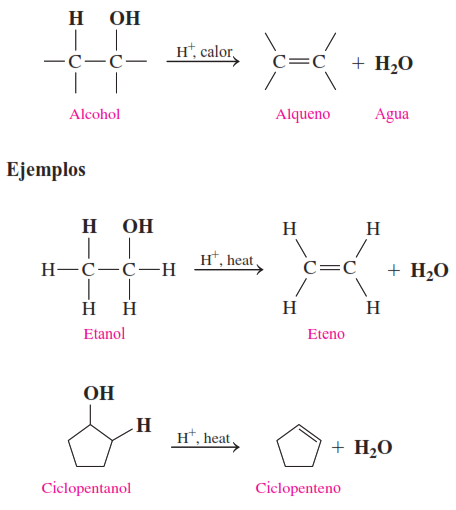
1. Deshidratación de alcoholes para formar alquenos
En una reacción de deshidratación, los alcoholes pierden una molécula de agua cuando se calientan a alta temperatura (180 °C) con un catalizador ácido como el H₂SO₄. Durante la deshidratación de un alcohol, los componentes H y OH se eliminan de átomos de carbono adyacentes del mismo alcohol para producir una molécula de agua. Se forma un enlace doble entre los mismos dos átomos de carbono para producir un producto de alqueno.
Ejemplo 1: Dibuja la fórmula estructural condensada para el alqueno producido por la deshidratación de lo siguiente:
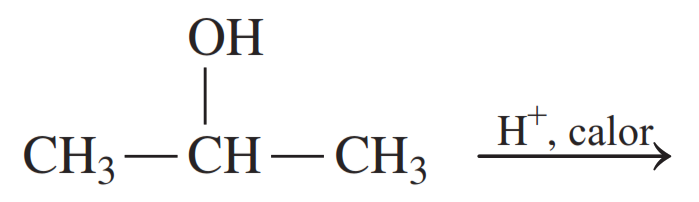
Solución:
En una deshidratación, el grupo —OH se elimina del carbono 2 y un H— se elimina de un carbono adyacente, lo que forma un doble enlace.

2. Oxidación de alcoholes primarios
En química orgánica, una oxidación implica la adición de oxígeno o la pérdida de átomos de hidrógeno. La oxidación de un alcohol primario produce un aldehído, que contiene un doble enlace entre el carbono y el oxígeno. Por ejemplo, la oxidación del metanol y del etanol ocurre al eliminar dos átomos de hidrógeno: uno del grupo —OH y otro del carbono que está unido al grupo —OH. La reacción se escribe con el símbolo [O] sobre la flecha para indicar que el oxígeno proviene de un agente oxidante, como el KMnO₄ o el K₂Cr₂O₇.
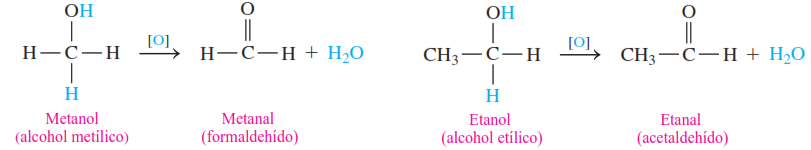
Los aldehídos se oxidan aún más mediante la adición de otro oxígeno para formar ácidos carboxílicos, que tienen tres enlaces carbono-oxígeno. Esta reacción ocurre con tanta facilidad que a menudo es difícil aislar el producto aldehído durante la reacción de oxidación.
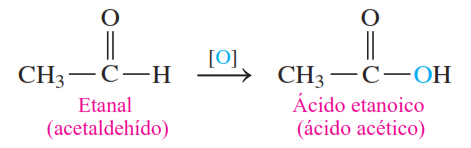
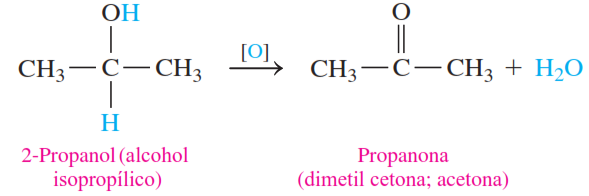
3. Oxidación de alcoholes secundarios
En la oxidación de alcoholes secundarios, los productos son cetonas. Se eliminan dos átomos de hidrógeno, uno del grupo —OH y otro del carbono unido al grupo —OH. El resultado es una cetona que tiene el enlace doble carbono-oxígeno unido a grupos alquilo o aromáticos en ambos lados. No hay una oxidación adicional de una cetona porque no hay átomos de hidrógeno unidos al carbono del grupo cetona.
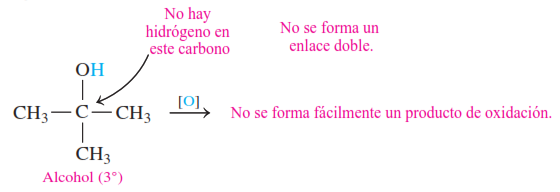
Los alcoholes terciarios no se oxidan fácilmente porque no hay un átomo de hidrógeno en el carbono unido al grupo —OH. Dado que los enlaces C — C son generalmente demasiado fuertes para oxidarse, los alcoholes terciarios resisten la oxidación.
Ejemplo 2: Clasifica cada uno de los siguientes alcoholes como primario (1°), secundario (2°) o terciario (3°); dibuja la fórmula estructural condensada o la fórmula de ángulos de línea para el aldehído o la cetona formada por su oxidación.
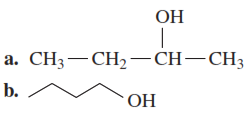
Solución:
a. Este es un alcohol secundario (2°), que puede oxidarse a una cetona.
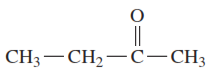
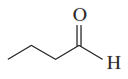
b. Este es un alcohol primario (1°), que puede oxidarse a un aldehído.
4. Reducción de aldehídos y cetonas
Los aldehídos y cetonas son reducidos por borohidruro de sodio (NaBH₄) o hidrógeno (H₂). En la reducción de compuestos orgánicos, hay una disminución en el número de enlaces carbono-oxígeno mediante la adición de hidrógeno o la pérdida de oxígeno. Los aldehídos se reducen a alcoholes primarios y las cetonas se reducen a alcoholes secundarios. Se necesita un catalizador, como níquel, platino o paladio, para la adición de hidrógeno al grupo carbonilo.
Los aldehídos se reducen a alcoholes primarios.
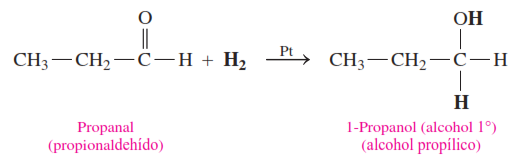
Las cetonas se reducen a alcoholes secundarios.
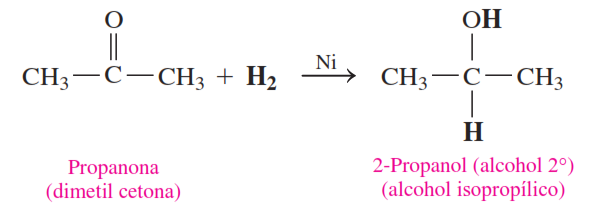
Ejemplo 3: Escribe una ecuación química balanceada para la reducción de la ciclopentanona utilizando hidrógeno en presencia de un catalizador de níquel.
Solución:
La molécula reactiva es una cetona cíclica que tiene cinco átomos de carbono. Durante la reducción, los átomos de hidrógeno se añaden al carbono y al oxígeno en el grupo carbonilo, lo que reduce la cetona al alcohol secundario correspondiente.
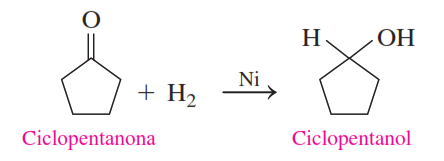
Ejercicios de práctica
1. Escribe la ecuación química balanceada para la combustión completa de cada uno de los siguientes compuestos:
a) metanol
b) 2-butanol
c) 1-propanol
d) 3-hexanol
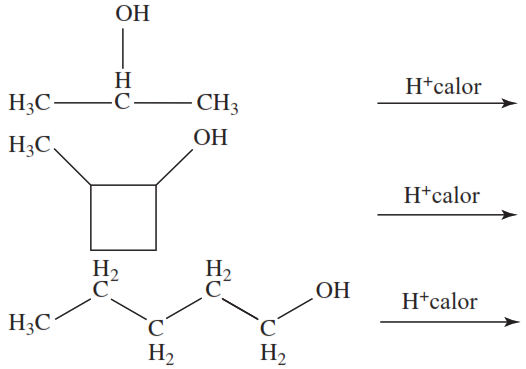
2. Dibuja la fórmula estructural condensada, o la fórmula esquelética si es cíclica, para el alqueno producido por cada una de las siguientes reacciones de deshidratación:
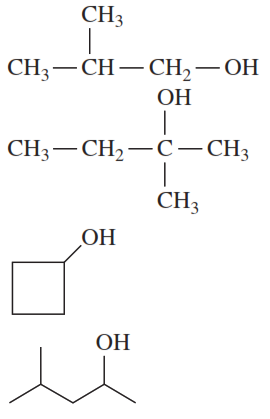
3. Dibuja la fórmula estructural condensada o la fórmula de líneas y ángulos para el aldehído o la cetona formada cuando cada uno de los siguientes alcoholes es oxidado [O] (si no hay reacción, escribe ninguno):
4. Dibuja las fórmulas estructurales condensadas para el aldehído y el ácido carboxílico producidos cuando cada uno de los siguientes se oxida: